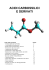COMPOSTI AROMATICI
Transcript
COMPOSTI AROMATICI
COMPOSTI AROMATICI L’aromaticità è l’aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. Caratteristiche Spettrali La maggior parte dei composti aromatici presenta un picco dello ione molecolare molto intenso. Spettrometria di massa Gli alchilbenzeni hanno una frammentazione molto facile con m/z 91. E’ stato dimostrato che il carbocatione benzilico traspone a catione eptatrienilio. CH2 R +. + CH2 . m/z 91 M+ m/z 91 M+ (128) (78) CH3 + R + 91 92 CH2 CH3 91 108 1 Il benzene ha legami π coniugati UV-visibile Lo spettro di assorbimento elettronico è caratterizzato da due bande dette “primarie” e una banda detta “secondaria” o della struttura fine. λ = 184 nm (ε = 47 000) A λ = 202 nm (ε = 7 000) struttura fine λ = 255 nm (ε = 230) È dovuta alle interazioni dei livelli elettronici con i modi vibrazionali stretching =C-H IR bending =C-H (fuori dal piano) stretching C=C nm a sinistra di 3000 cm-1 900-690 cm-1 spesso in coppia a 1600 e 1475 cm-1 2 CH2 CH3 13C NMR L’anisotropia diamagnetica descherma il nucleo δ 120-140 ppm 1H NMR L’anisotropia diamagnetica descherma il nucleo δ 7-8 ppm 3 COMPOSTI AROMATICI I composti aromatici reagiscono MANTENENDO l’aromaticità ADDIZIONE H + E+ E + SOSTITUZIONE H+ possibili meccanismi? 1) meccanismo sincrono H δ+ E δ+ E + E+ 2) meccanismo in due stadi H H E E + + + +E + E + H + H E Evidenze sperimentali La reazione è stata eseguita sul deuterobenzene D D D D D k / kH = 1 D D il legame C-D è piu forte del legame C-H: significa che nello stadio lento non c'e rottura del legame C-H 4 CH3 In alcuni casi si è riusciti ad isolare l'intermedio H H + H3C H CH3 + BF4 H SbF6 MECCANISMO IN DUE STADI MECCANISMO DELLA SOSTITUZIONE ELETTROFILA AROMATICA primo stadio =/ E δ+ H lento + E E+ + H δ+ addotto sigma primo stato di transizione strutture di risonanza dell'intermedio secondo stadio H E + + H E H δ+ E H + H E =/ E veloce E + δ+ secondo stato di transizione Energia in funzione della coordinata di reazione: 1° ST 2° ST E + H E --------------- E - 10.8 kcal/mole ---------------------------------coordinata di reazione 5 Tutte le variazioni strutturali che abbassano l'energia dell'intermedio abbassano anche l'energia dello stato di transizione che porta all'addotto σ e quindi rendono più facile la reazione. SOSTITUZIONI ELETTROFILE AROMATICHE principali reazioni di Sostituzione Elettrofila NO2 + NITRAZIONE HNO3 H2SO4 + H2O SO3H + SOLFONAZIONE SO3 H2SO4 X FeX ALOGENAZIONE + X2 + HX Cl (X = Cl) + Cl2 FeCl3 + HCl clorurazione + HBr bromurazione Br (X = Br) FeBt3 + Br2 R + RX ALCHILAZIONE AlCl3 + HX Alchilazione di Friedel-Crafts O AlCl3 O ACILAZIONE + R X R + HX Acilazione di Friedel-Crafts Queste reazioni permettono di introdurre nel benzene gruppi funzionali diversi, ma avvengono con lo STESSO MECCANISMO. E' perciò importante capire quale è il reagente elettrofilo e come si forma. 6 Nitrazione + HNO3 + H2SO4 + HSO4 H O NO2 - H + +NO H 2O + H O NO2 E+ 2 H catione NITRONIO H3O+ + HSO4= H2O + H2SO4 NO2+ + H3O+ + 2 HSO4= HNO3 + 2 H2SO4 H +NO 2 + NO2 NO2 + H+ Solfonazione O E+ S O O + O HO S O + S O SO3H HO O O + SO3H S OH H+ O Alogenazione Cl Cl + FeCl3 FeCl4 Cl+ + "Cl+" + - H + - Cl FeCl4 Cl E+ H+ ClFeCl3 Br Br + FeBr3 H + Br+ + Br - FeBr4 FeBr4 - + "Br+" E+ Br H+ BrFeBr3 7 Alchilazione (di Friedel-Crafts) δ+ δR Cl + AlCl3 δδ+ R ... Cl ... AlCl3 - H R+ + "R+ AlCl4 + R E+ R H+ AlCl3 Acilazione (di Friedel-Crafts) R Cl δ+ C δO R + AlCl3 + C O: R R + C + R C + + O C O+ R - AlCl4 + R C O + + C R O O AlCl4 C R + AlCl3 O C H+ ClAlCl3 O AlCl3 si deve usare in quantità stechiometrica perché dà complesso di Lewis con il prodotto E+ H O H C AlCl3 R Sostituzioni elettrofile aromatiche dei Benzeni SOSTITUITI Tutte le posizioni del benzene sono equivalenti. Quando c'è un sostituente, le posizioni sono diverse: 2 orto, 2 meta e 1para se i prodotti si formassero solo su basi statistiche, si dovrebbe avere 40% di orto, 40% di meta e 20% di para a distribuzione dei prodotti osservata sperimentalmente non è MAI quella statistica questo significa che il sostituente presente sull'anello del benzene indirizza l'attacco dell'elettrofilo ORIENTAMENTO per esempio: CH3 E+ H+ CH3 + E E CH3 CH2Cl CH2Cl E+ H+ E Non è un effetto del sostituente sul substrato! 8 Stadio lento: formazione dell’addotto σ: più stabile è l'addotto sigma, minore è l'energia dello stato di transizione che porta all'addotto. ORIENTAMENTO 1. Si scrivono tutti i possibili addotti e le rispettive strutture di risonanza. 2. Si esamina se c'è una struttura con la carica positiva sul C che lega il sostituente. 3. Si guarda se il sostituente stabilizza (o destabilizza) la carica positiva. CH3 H + E CH3 + E+ CH3 CH3 H E + CH3 H E + + E CH3 H E + CH3 CH3 CH3 CH3 H E + H E CH3 CH3 + + + H E H E H CH3 E benzene H + meta E H orto,para CH3 + + + E+ E CH3 H + E H CH3 E E + E+ E coordinata di reazione La reattività del benzene sostituito rispetto a quella del benzene dipende dall'energia di attivazione dello stadio lento e si vede dalla stabilità dell'addotto σ più stabile (del benzene sostituito) rispetto a quella dell'addotto del benzene. 9 + CH2Cl H CH2Cl H + E CH2Cl E+ + E + + + H H H E CH2Cl E CH2Cl E CH2Cl E CH2Cl CH2Cl CH2Cl + CH2Cl H + + + H H E CH2Cl + orto,para H E E H CH2Cl H + E E meta CH2Cl E benzene H E + + H E CH2Cl o + E+ coordinata di reazione 10 OH OH OH + + E+ OH H H E + + H E E + OH H E OH OH OH + + H H + H E E E OH OH OH + + + H E + E H OH H E H E OH meta + H E benzene E + H E orto,para + + OH OH + H H E E OH + E+ + E+ coordinata di reazione coordinata di reazione 11 CH2Cl CH2Cl H + E + orto,para H E meta CH2Cl E benzene H E + + H E CH2Cl + E+ o coordinata di reazione NO2 NO2 NO2 + + E+ E H E + E + NO2 NO2 NO2 + + H H + NO2 H H E NO2 H E NO2 E NO2 + + + H E H E H E 12 NO2 NO2 H + + E H orto,para E meta NO2 E benzene H + E H + E NO2 + E+ o coordinata di reazione Cl Cl Cl Cl H H + + E+ E H E + E + + Cl H E Cl Cl Cl + + H H + E E E Cl Cl H Cl + + + H E H Cl + E H H E E 13 Cl meta + H E orto,para Cl+ E Cl+ H E benzene H E + H E Cl + E+ o coordinata di reazione reagisce meglio con centri RICCHI di elettroni E+ è specie a difetto elettronico REATTIVITA’ Si deve considerare la densità elettronica delle POSIZIONI REATTIVE (orientamento) Esempio: mettere i seguenti composti in ordine decrescente di reattività, nei confronti di un reagente elettrofilo NO2 OCH3 CH3 Cl 1. Si individua la posizione (o le posizioni) di attacco, cioè l'orientamento (sulla base della stabilità degli addotti σ). 2. Si considera l'effetto del sostituente SU QUELLA POSIZIONE. 3. Maggiore è la densità elettronica, maggiore è la reattività (a parità di elettrofilo). 14 Tutte le posizioni sono equivalenti. Non ci sono sostituenti, la densità elettronica è quella di riferimento. Orientamento in META. In questa posizione il gruppo NO2 esercita solo l'effetto induttivo. NO2 attrazione elettronica -I Le posizioni reattive del nitrobenzene sono più povere di elettroni (e quindi MENO reattive) delle posizioni reattive del benzene Orientamento in ORTO + PARA. In queste posizioni il gruppo OCH3 esercita sia l'effetto induttivo che quello coniugativo. OCH3 rilascio elettronico -I , + R Le posizioni reattive del metossibenzene sono più ricche di elettroni (e quindi PIU’ reattive) delle posizioni reattive del benzene CH3 Orientamento in ORTO + PARA. In queste posizioni il gruppo CH3 esercita solo l'effetto induttivo. rilascio elettronico +I Le posizioni reattive del metilibenzene sono più ricche di elettroni (e quindi PIU’ reattive) delle posizioni reattive del benzene Orientamento in ORTO + PARA. In queste posizioni il gruppo OCH3 esercita sia l'effetto induttivo che quello coniugativo. Cl -I , + R attrazione elettronica Le posizioni reattive del clorobenzene sono più povere di elettroni (e quindi MENO reattive) delle posizioni reattive del benzene Il rilascio elettronico dovuto a risonanza è maggiore di quello induttivo (alchili) Reattività: CH3 OCH3 > > Cl > > NO2 15 Sostituzioni Elettrofile sul NAFTALENE A differenza del benzene, le posizioni del naftalene non sono tutte equivalenti: ORIENTAMENTO α α β β β per conoscere l’orientamento, basta confrontare gli addotti sigma nelle posizioni α e β + E+ β α α E H E H E H + + + H H + H E E E + + L’altro anello mantiene la completa aromaticità 2 volte su 3 nella risonanza dell’addotto in α, solo 1 nella risonanza dell’addotto in β e quindi è più stabile Le sostituzioni elettrofile aromatiche sul naftalene avvengono in α NO2 H2SO4 + HNO3 + +H Un caso a parte è la solfonazione, in cui l’orientamento dipende SO3H dalla temperatura T<100oC H2SO4 H2SO4 , Δ + SO3 SO3H T>150oC E a T<100°C: controllo cinetico, a T>150°C: controllo termodinamico α β O H O H S O H O S O OH coordinata di reazione H 16 REAZIONI CON ELETTROFILI DEBOLI Avvengono solo con aromatici MOLTO reattivi 1. Reazione con i sali di benzendiazonio :OH + OH OH H N N N N+ X - + HX N N 4-idrossiazobenzene L’elettrofilo (voluminoso) va in in orto solo se la posizione para è occupata Reagiscono solo: benzenolo (=fenolo) e benzenammina (=anilina) (e analoghi del naftalene) 2. Reazione di carbossilazione (Reazione di Kolbe) O - Na+ CO2 OH O C Δ O + O δO C δ+ + H O O C - O O OH O C - + solo con fenolo O - Na+ - O H O C + - O OH O C O OH H C O O O H O C O acido salicilico (acido 2-idrossibenzencarbossilico) O C OH O aspirina C O CH3 (acido acetilsalicilico) acido 2-acetossibenzencarbossilico 17 3. Reazione di formilazione (reazione di Reimer-Tiemann) O - Na+ Na+ - O solo con fenolo O C CHCl3 H KOH - CHCl3 + -OH O- O:CCl2 + Cl- + :CCl2 :CCl3 O H CCl2 + OH O- H CCl2 - - OH O C OH OH C OH H CHCl2 H2O HO- O H + CCl2 + - Elettrofilo H H CCl2 - aldeide salicilica (2-idrossibenzencarbaldeide) 4. Reazione di idrossimetilazione solo con fenolo O- O O H O + C H H + H CH2 O - CH2 OOH OH CH2 OH + CH2 OH O OH CH2 OH OH CH2 OH CH2 CH2 OH O H2O O H H2O o-chinometano p-chinometano CH2 18 PREPARAZIONE E REATTIVITA' DEI SALI DI BENZENDIAZONIO [H] NH2 NO2 (Fe, HCl) HNO3 + N N NaNO2, HCl, O°C [O] H2SO4 (CF3CO3H) + OH N N H2O, Δ Cl - H H3PO2 CuCl Cl KI CuCN CuBr Br AgBF4 I C N NaNO2, +N N Cu -- F BF4 (solido) Δ NO2 USO DEI SALI DI BENZENDIAZONIO 1. Introduzione di gruppi che non si possono introdurre diversamente OH -OH è nucleofilo il benzene reagisce con gli elettrofili da HNO3 NH2 NaNO 2 HCl, 0°C NO2 [H] H2SO4 H2O -OH OH + + N N Cl- N2 2. Introduzione di un secondo sostituente in una posizione diversa da quella possibile con una sostituzione elettrofila aromatica, sulla base dell'orientamento provocato dal primo sostituente N C esempi H3 C ? 19 PROBLEMI difficile introdurre CN CN orienta un elettrofilo in meta sali di benzendiazonio SOLUZIONE CH3 CH3 (CH3CO)2O NH2 NH C CH3Br NH C O AlCl3 CH3CO2H O H3C serve per ingombrare stericamente le posizioni orto ed avere solo la sostituzione in para e per diminuire la reattività altrimenti si avrebbero prodotti di polimetilazione H2O, H+ NH2 NaNO 2 HCl, 0°C H 3C CH3 + N N ClH3C PROBLEMA Br N2 sali di diazonio CH3 Br Br2 NH C H3C sia -CH3 che -Br orientano in orto, para SOLUZIONE CH3 C N CuCN -NHCOCH3 NH C (|+R|>|-I|) O O gruppo a rilascio elettronico più forte di -CH3 FeBr3 H C 3 H3C (preparato come prima) CH3 Br NH C Br H2O, H+ NH2 O H2SO4, 0°÷ 5°C H3C H3C Br H3C + N N HSO4- NaNO2 Br H3PO2 H H3C 20 Br ? Br Br - Br orienta in orto, para PROBLEMA Br2 Br Br2 Br Br + FeBr3 FeBr3 Br Br Br2 FeBr3 Br Br + Br Br SOLUZIONE NH2 SALI DI DIAZONIO Br2 NH2 Br Br gli atomi di Br sono nella posizione relativa voluta: basta togliere il gruppo -NH2 H2O in queste condizioni reagiscono tutte le posizioni influenzate da -NH2 Br N NH2 Br Br Br Br X- N+ NaNO2 Br Br H3PO2 Br Br HX, 0°÷ 5°C Br Br Br 21 REATTIVITA' DI ANTRACENE E FENANTRENE CON I REAGENTI ELETTROFILI L'aumento del numero di anelli condensati diminuisce l'aromaticità Fenantrene ed antracene (meno aromatici di benzene e fenantrene) danno ANCHE REAZIONI DI ADDIZIONE il legame C9-C10 ha caratteristiche di un doppio legame poco delocalizzato FENANTRENE Br2 + (FeCl3) Br Br Br 9-bromofenantrene 9,10-dibromo-9,10-diidrofenantrene nel nome del prodotto di addizione va indicata la presenza dei due H : 9,10-dibromofenantrene indica che in 9 e 10 ci sono due atomi di Br AL POSTO DI DUE H ATTENZIONE!! Br Br 9,10-dibromofenantrene il fenantrene si comporta con HX come un alchene HCl 9-cloro-9,10-diidrofenantrene Cl L'addizione avviene al legame C9-C10, perché in questo modo rimane intatta l'aromaticità degli altri due anelli benzenici Si comporta anche come un diene coniugato, dando prodotti di addizione 1,4, oltre ai prodotti di sostituzione elettrofila aromatica (in posizione 9) ANTRACENE Br Br Br2 + (FeCl3) Br 9-bromoantracene 9,10-dibromo-9,10-diidroantracene L’antracene dà le caratteristiche reazioni dei dieni coniugati e perciò reagisce con elettrofili del tipo HX e con i dienofili 22 HX 9-X-9,10-diidroantracene X O O O O O O addotto di Diels-Alder O O O Reazioni in catena laterale I benzeni sostituiti possono reagire anche in catena laterale (cioè sul sostituente), se si usano condizioni opportune. CH2 Cl hν CH3 + Cl2 CH3 CH3 Cl FeCl3 Br CH CH3 CH CH2 + HBr + Cl REAZIONI DI OSSIDAZIONE Si ossidano a acido benzencarbossilico Monoalchilbenzeni CH3 KMnO4, OH- OC O H+ OH C O Δ 23 CH2 CH3 KMnO4, OH- Δ CH2 (CH2) CH3 n KMnO4, OH- Δ Anello benzenico OC O CO2 + OH H+ C OC O (n + 1) CO2 + O OH H+ C O molto resistente all'ossidazione O O2, V2O5 O 400-440°C O O O2, V2O5 Il naftalene è un po’ più facile da ossidare O 350-400°C O Un’ossidazione meno drastica si può avere con CrO3 e gli aromatici con più anelli condensati O CrO3 1,4-naftalenchinone (1,4-naftochinone) O O CrO3 CrO3 O O 9,10-fenantrenchinone benzendioli OH OH O 9,10-antracenchinone Si ossidano molto facilmente a chinoni Ag2O O O o-benzochinone OH HO O Ag2O O p-benzochinone 24 REAZIONI DI RIDUZIONE - Con H2 La riduzione catalitica richiede pressioni e temperature elevate per la prima addizione (perdita dell’aromaticità), mentre le addizioni successive sono più facili. 3 H2, P, Δ cat. (Pt, Pd, Ni, Ru, o Rh) - Con Na° Riduzione di Birch Na (o Li) NH3 liquida, CH3CH2OH meccanismo: . + Na° CH3CH2OH H .. - H H CH3CH2OH H H CH3CH2O- H carbanione H Se la reazione si effettua su un benzene sostituito Si formano carbanioni Na° H radicale anione radicale CH3CH2O .. - . ORIENTAMENTO stabilizzati da gruppi ad attrazione elettronica, destabilizzati da gruppi a rilascio elettronico Un carbonio che porta un gruppo ad attrazione elettronica viene ridotto CO2H CO2H CO2H Na (o Li) H H H NH3 liquida, CH3CH2OH H H intermedio stabilizzato Un carbonio che porta un gruppo a rilascio elettronico non viene ridotto H H CH3 CH3 Na (o Li) NH3 liquida, CH3CH2OH H H - H H intermedio destabilizzato H H O CH3 O Na (o Li) NH3 liquida, CH3CH2OH H H CH3 CH3 H H - O CH3 intermedio destabilizzato 25 Il benzene non reagisce con i nucleofili Però ….. + Nu- la sintesi industriale del fenolo parte dal clorobenzene Cl OH KOH, Δ, P …..e allora ???? KCl SOSTITUZIONE NUCLEOFILA AROMATICA Perché i composti aromatici possano reagire con NUCLEOFILI, devono possedere i seguenti requisiti 1. BUON GRUPPO USCENTE 2. SOSTITUENTE/I A FORTE ATTRAZIONE ELETTRONICA (NO2) In questo caso si ha: Meccanismo di ADDIZIONE-ELIMINAZIONE La reazione avviene in due stadi, con formazione nello stadio lento di un intermedio (addotto σ negativo o complesso di Meisenheimer), stabilizzato per risonanza dal sostituente CH Cl O CH3 Cl + - O CH 3 + - N O O δ- OCH 3 O lento - O N+ O - O N+ O δ- Cl 3 Cl Cl OCH3 δ- δ- X - Cl Cl OCH3 Cl OCH3 - - Cl OCH3 E OCH3 X + - N O O X + - N O O N+ O- O OCH3 X =/ ΔH Cl OCH3 X coordinata di reazione N -O + O 26 Evidenze sperimentali: qualche complesso di Meisenheimer è stato isolato F Cl è più reattivo di il legame C-F è più forte di C-Cl, ma NO2 NO2 il legame con il gruppo uscente non si rompe nello stadio lento e F (più elettronegativo) favorisce l'attacco del nucleofilo, rendendo più positivo il C a cui è legato Però ….. la sintesi industriale del fenolo parte dal clorobenzene Cl OH KOH, Δ, P …..e allora ???? KCl Se manca il sostituente a forte attrazione elettronica, si può avere reazione con i nucleofili, purché vengano soddisfatti i seguenti requisiti: 1. BUON GRUPPO USCENTE KOH (solida) NaNH2 in NH3 liquida 2. il nucleofilo è UNA BASE FORTE In questo caso si ha: Meccanismo di ELIMINAZIONE-ADDIZIONE La base forte strappa un protone acido (in orto al gruppo uscente) e la base coniugata forma il benzino, che, essendo molto reattivo, addiziona l'acido coniugato della base Cl H Cl H OH H .. + -OH - + H2O H2O Cl- BENZINO OH H l'addizione può avvenire in entrambi i modi H HO Evidenze sperimentali: Cl * OH OH -OH * + * * = 13C Cl- con un clorobenzene sostituito si hanno miscele di prodotti 27 p-metilclorobenzene NH2 Cl H NH2 + NH2- + CH3 CH3 CH3 Cl - CH H H Cl 2 H 2N .. - + NH3 H NH2 ClCH3 CH3 o-metilclorobenzene Cl H CH3 H NH 2 H2N H NH2 CH3 CH3 H2N CH3 + Cl- o-metilclorobenzene Cl H H H3 C H2 N Cl- H2 N H + H3 C H3 C H + H3 C H3 C NH2 NH2 NH2 + + CH3 CH3 CH3 28
Documenti analoghi
7. Formazione di legami C-C
 Ovviamente, la reattività principale di un carboanione è quella di nucleofilo. Le più
importanti reazioni di sintesi di legami C-C che fanno uso di carboanioni possono
essere classificate in tre ca...
Ovviamente, la reattività principale di un carboanione è quella di nucleofilo. Le più
importanti reazioni di sintesi di legami C-C che fanno uso di carboanioni possono
essere classificate in tre ca...
Appunti di Chimica - Gli studenti dell`università di Chieti
 macroscopiche risultanti dal comportamento medio di un numero grande di fenomeni
elementari concorrenti.
macroscopiche risultanti dal comportamento medio di un numero grande di fenomeni
elementari concorrenti.