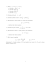1) Sapendo che la formula dell`ortosilicato di magnesio è Mg 2SiO4
Transcript
1) Sapendo che la formula dell`ortosilicato di magnesio è Mg 2SiO4
1) Sapendo che la formula dell’ortosilicato di magnesio è Mg2SiO4 calcolare: a) La composizione percentuale degli elementi e la composizione percentuale dei due ossidi (di magnesio -MgO- e di silicio -SiO2-. b) Calcolare la massa in kg di Mg ottenibile da una tonnellata di minerale se la purezza dello stesso è pari al 87.1% . c) Se un campione di 0.4756 g di tale minerale viene attaccato con HF e la soluzione diluita a 500 ml, calcolare il contenuto % di ferro del minerale se la soluzione finale analizzata in spettrometria di emissione di plasma (ICP-AE) mostra una conc. di ferro di 1.49 ppm (o mg / l). 2) Calcolare a quale volume occorre diluire 30.0 ml di H2SO4 al 24% in peso (d. = 1.17 kg / l) per ottenere una soluzione 0.500 M. b) se dopo una diluizione un po’ approssimata tale soluzione è titolata con KOH secondo la seguente reazione non bilanciata: H2SO4 + KOH ——→ K2SO4 + H2O in cui 25 ml di acido reagiscono con 36.7 ml di base alla conc. di 0.809 N, calcolare la concentrazione esatta dell’acido. 3) calcolare il pH di un litro di soluzione di ipoclorito di sodio (NaClO) 0.1 M ( Ka dell’acido debole libero 2.9 *10-8 ) dopo l’aggiunta dello stechiometrico esatto di un acido forte (come ad esempio HCl ) considerando un volume finale della soluzione raddoppiato. b) se dalla soluzione contenente acetato di sodio volessimo ottenere una soluzione tampone delle soluzioni seguenti dovremmo aggiungere: i) 0.51 l di NaOH 0.1M, ii) 0.48 l di HCl 0.1M ììì) 0.75 l di NH4OH 0.1M iv) lo stechiometrico di NaOH v) lo stechiometrico di NH4OH vi) un eccesso di HCl vii) un eccesso di NH4OH Stabilire i coefficienti delle seguenti reazioni. Ca3(AsS4)2 Ce(IO3)4 + + H2C2O4 HCl ——→ ——→ CaCl2 Ce(C2O4)3 + As2 S5 + I2 + + H2S H2O + CO2