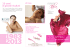principali numeri di ossidazione di alcuni elementi
Transcript
principali numeri di ossidazione di alcuni elementi
PRINCIPALI NUMERI DI OSSIDAZIONE DI ALCUNI ELEMENTI GRUPPO ELEMENTI H NUMERI DI OSSIDAZIONE +1 I Li, Na, K, Rb, Cs +1 II Be, Mg, Ca, Sr, Ba +2 III B, Al, Ga, In, Tl +3 IV C V VI –1 negli idruri metallici – 4 ; + 4, + 2 Si, Ge +4 Sn, Pb + 2, + 4 N NOTE + 1,+ 2, + 3, + 4, + 5 − 3 nei composti senza ossigeno P, As, Sb, Bi + 3, + 5 (nitruri, fosfuri, arseniuri…) O −2 −1 nei perossidi + 2 in OF2 S, Se, Te − 2; + 4, + 6 −2 senza ossigeno (solfuri, seleniuri…) VII F −1 Cl + 1, + 3, + 5, + 7 −1 senza ossigeno (cloruri, Br + 1, +5 bromuri, ioduri) I + 1, +5, + 7 Elementi Sc +3 di Ti +4 transizione V +5 Cr* + 2, + 3, + 6 Mn* + 2, + 3, + 4, + 6, + 7 Fe, Co, Ni + 2, + 3 Cu + 1, + 2 Zn, Cd +2 Hg + 1, + 2 Ag +1 Cr2+ ione cromoso Cr3+ ione cromico CrO2 ione cromito CrO42 ione cromato Cr2O72 ione bicromato Mn2+ ione manganoso Mn3+ ione manganico MnO42 ione manganato MnO4 ione permanganato * Cr e Mn a basso numero di ox si comportano come metalli (danno ioni positivi) Ad alto numero di ox si comportano come non metalli (formano ossianioni, come MnO42 − e MnO4−