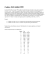I passaggi di stato - LEZIONI DI CHIMICA
Transcript
I passaggi di stato - LEZIONI DI CHIMICA
I PASSAGGI DI STATO DELLE SOSTANZE Si sa che la materia si può presentare in tre diversi stati di aggregazione dipendenti dalla temperatura (a pressione costante): a basse temperature prevale lo stato solido mentre, mano a mano che la temperatura aumenta, si passa agli stati liquido e aeriforme. L’acqua è forse l’unico materiale che si trova comunemente in tutti e tre gli stati di aggregazione (liquida quando esce dal rubinetto, vapore quando la riscaldiamo sul fornello e solida quando la mettiamo nel freezer). Gli altri materiali possono essere visti nei tre diversi stati di aggregazione solo portandoli a temperature molto più alte o molto più basse di quella ambiente. Ogni sostanza presenta comunque temperature di passaggi di fase caratteristiche, cosa che non accade invece per un miscuglio. Lo stato aeriforme può essere gassoso se la sostanza esaminata si trova in condizioni normali allo stato aeriforme: è il caso dell’azoto molecolare, dell’elio o dell’ossigeno; si parla invece di un vapore quando la sostanza si trova in condizioni ordinarie (t0 25°C e p=1 atm) allo stato liquido, ed è proprio il caso dell’acqua. La variazione di pressione può cambiare lo stato di una sostanza, come accade al ghiaccio che, sotto la pressione del pattino, fonde o dell’ossigeno che sotto pressione condensa. Ogni sostanza presenta infatti un diagramma di stato che riporta le tre regioni relative ai tre diversi stati di aggregazione in funzione di temperatura e di pressione. A titolo esemplificativo viene riportato il diagramma di fase dell’acqua. In fisica e chimica si aggiunge a questi tre stati classici almeno un altro stato, detto il quarto stato, che è il plasma. Il plasma è un gas ionizzato, costituito da un insieme di elettroni e ioni e globalmente neutro (la cui carica elettrica totale è cioè nulla). Esercizi: 1) prova a completare lo schema rappresentato inserendo correttamente il tipo di stato e il nome dei sei possibili passaggi di stato ………………….. stato ………... ……………….. stato ………... …………….. evaporazione ……………….. ………………….. stato ………... ………………….. 2) Completa la tabella relativa alle caratteristiche dei tre diversi stati di aggregazione della materia forma SOLIDO Volume definita LIQUIDO AERIFORME 3) Stabilisci lo stato di aggregazione dei seguenti sistemi. Scegli tra solido, liquido, aeriforme (specificando se vapore o gas) a) umidità dell'aria ………………..; b) legna da ardere ………………..; c) acqua di un torrente ………………..; d) nuvole nel cielo ………………..; e) un tronco ………………..; f) un mobile ………………..; g) l'acqua in un bicchiere ………………..; h) l'ossigeno che respiriamo ………………..; i) l'anidride carbonica che espiriamo ………………..; l) l'idrogeno dell'aria ………………..; m) l’elio contenuto in un palloncino ………………… Soluzioni: 1) sublimazione, olido, fusione liquido, ebollizione, solidificazione, brimnamento, condensazione, aeriforme 2) definita, definita, indefinita, indefinita, indefinita 3) v,s,l,v,s,s,l,g,g,g,g Lo stato solido è caratterizzato da un elevato ordine tra le particelle che lo costituiscono. Le particelle infatti sono vincolate in posizioni reciproche ben definite e possono al massimo vibrare attorno alle loro posizioni di equilibrio. Aumentando la temperatura, aumenta proprio l’ampiezza delle oscillazioni di atomi e molecole attorno alle loro posizioni di equilibrio. Arrivati alla temperatura di fusione accade che l’energia accumulata sotto forma di energia cinetica permette alle particelle di svincolarsi dalla posizione rigida dello stato solido e di scivolare le une sulle altre: il volume aumenta ma in maniera non molto significativa per cui le particelle risultano ancora molto vicine tra di loro. Attenzione: l’acqua è l’unica sostanza per cui la fusione non determina un aumento di volume. Accade infatti che allo stato solido la stessa quantità di acqua occupa un volume maggiore che allo stato liquido e, ad esempio, la bottiglia d’acqua in freezer si rompe. Durante la sosta termica di fusione il calore assorbito non determina un aumento di temperatura ma la possibilità per le particelle di muoversi le une rispetto alle altre, cioè di cambiare il modo (lo stato) con cui sono legate. L’energia coinvolta non è più di tipo cinetico ma potenziale, dato che adesso le particelle possono cambiare le loro posizioni reciproche. Il calore assorbito, detto calore latente di fusione, dipende ancora dal tipo di sostanza ma, essendo il calore una grandezza estensiva, va rapportato alla massa unitaria di sostanza considerata. Terminato il processo di fusione la temperatura riprende a salire: aumenta corrispondentemente la velocità con cui le particelle possono muoversi fino alla successiva sosta termica che vedrà le stesse particelle in grado di svincolarsi definitivamente le une dalle altre e di liberarsi allo stato aeriforme. Il calore coinvolto durante l’ebollizione, che ancora una volta non determina innalzamenti di temperatura, viene detto calore latente di ebollizione: dipende dalla particolare sostanze e va rapportato alla massa unitaria. Le caratteristiche dello stato aeriforme saranno molto diverse da quelle dello stato solido e liquido, in particolare la densità è molto più bassa e la comprimibilità molto più elevata. I passaggi di stato delle miscele non presentano soste termiche nette come nel caso delle sostanze pure. Nella tabella che segue sono riportati il calore latente e la temperatura di passaggio di stato per alcune sostanze. Si noti l’alto calore latente di fusione e di ebollizione dell’acqua. Calore latente e temperatura al cambio di stato di sostanze comuni alla pressione atmosferica Sostanza Calore latente Temperatura Calore latente Temperatura di fusione di fusione di ebollizione di ebollizione [kJ/kg] [°C] [kJ/kg] [°C] Etanolo 108 -114 855 78,3 Ammoniaca 339 -75 1369 -33 Biossido di carbonio 184 -57 574 -78 Elio 1.25 -269,7 21 -268,93 Idrogeno 58 -259 455 -253 Azoto 25,7 -210 200 -196 Ossigeno 13,9 -219 213 -183 Mercurio 11 -39 294 357 Zolfo 54 115 1406 445 Acqua 333,5 0 2272 100 Esercizi 1) Completa la tabella indicando lo stato fisico delle sostanze A,B,C a temperatura ambiente (t = 20°C; p = 1 atm). Sostanza tfusione(°C) tebollizione(°C) A 645 1300 B -7 59 Stato fisico C -165 -92 2) Spiega in cosa differiscono la temperatura di fusione e la temperatura di solidificazione della stessa sostanza alla stessa pressione. …………………………………………………………………………………………………………………………. 3) Completa la seguente tabella relativa ai passaggi di stato Passaggio di stato dallo stato allo stato liquido aeriforme fusione solido brinamento liquido solido sublimazione liquido 4) Commenta il grafico relativo all’analisi termica di una sostanza incognita completando il testo che segue: 100 80 t(°C) 60 40 20 0 -20 0 50 100 150 200 250 -40 -60 t(minuti) a. La sostanza incognita fonde a ………..°C e …………... a 50 °C. b. A temperature inferiori a ………. la sostanza si trova allo stato solido, per cui ha ……….. e …………… definiti. c. Alla temperatura di -10°C inizia il processo di ……………..: coesistono pertanto le due fasi …………. e ………………. mentre la temperatura si mantiene a ……….°C. d. Dopo circa 80 minuti la temperatura riprende a salire: la sostanza si presenta ora in una sola fase, quella ………….; la forma è …………………… mentre il volume è ……………………. e. Lo stato di agitazione termico aumenta fino alla temperatura di ……….°C, temperatura alla quale inizia il processo di ……………….. f. Durante la seconda sosta termica che avviene alla temperatura di …….. °C la sostanza si presenta in due fasi: …………. e ………………. in un equilibrio omogeneo/eterogeneo. g. Al termine della sosta termica la sostanza si presenta tutta in fase ………………………… h. Dato che le soste termiche sono nette si può dedurre che la sostanza è …………. i. Il calore assorbito durante i processi di riscaldamento è facilmente calcolabile noti i calori specifici della sostanza in esame negli intervalli considerati, la variazioni di ……………….…. e la …………..…. l. Il calore assorbito durante i passaggi di fase si ottiene moltiplicando il ………………… di fusione o di …………….. per la …………….. della sostanza. 5) Analogamente a quanto fatto nell’esercizio precedente, commenta il grafico che segue. 300 250 200 t(°C) 150 100 50 0 -50 0 100 -100 200 300 400 500 600 t(minuti) …………………………………………………………………………………………………………………………. …………………………………………………………………………………………………………………………. …………………………………………………………………………………………………………………………. …………………………………………………………………………………………………………………………. …………………………………………………………………………………………………………………………. …………………………………………………………………………………………………………………………. …………………………………………………………………………………………………………………………. 6) Quali sono i passaggi di stato coinvolti? sostanza caratteristiche mercurio da 1500°C a 1600 °C acqua da 120°C a 25°C etanolo da -100°C a 100°C zolfo da 300°C a 50°C elio da 30°C a -30°C Passaggio/i di stato 7) Calcola il calore in gioco durante i seguenti processi che avvengono tutti alla pressione di 1 atmosfera. Ricorda che 1 cal=4,18J. a) riscaldamento dell’acqua (100 g) da 30 a 70 °C. …………………………………………………………………………………………………………………… b) riscaldamento e completa ebollizione di 2 L di acqua da 20 °C a 100 °C. ……………………………………………………………………………………………………………………. …………………………………………………………………………………………………………………….. c) fusione di 250 g di mercurio a -39°C. ……………………………………………………………………………………………………………………. Soluzioni: 1) solido, liquido, gassoso 3) solido, liquido, ebollizione aeriforme, solidificazione, solido, aeriforme, solidificazione 4) -10°C, bolle; b) -10°C, forma, volume; c) fusione, solida e liquida, -10°C; d) liquida, indefinita, definito; e) 50°C, ebollizione; f) 50, liquida, aerifome, eterogeneo; g) aeriforme; h) pura; i) temperatura, massa; l) ebollizione, massa 6) nessuno, condensazione, ebollizione, solidificazione, nessuno 7) 4000 cal, 5213 kJ, 2,75 kJ L’energia interna L’energia interna del sistema aumenta durante il riscaldamento e si accumula sottoforma di energia cinetica delle particelle che si muovono più velocemente mentre durante la fusione e l’ebollizione, dal momento che la temperatura non si discosta da un valore di equilibrio, si accumula sotto forma di energia chimica di legame. Le stesse quantità di energia dovranno essere rilasciate dal sistema durante i processi di raffreddamento, che determinano un rallentamento delle particelle, e i passaggi di stato di condensazione e solidificazione, dove la stabilità delle fasi più aggregate vede la liberazione dell’energia in eccesso. Energia cinetica Energia interna se si evidenziano variazioni di temperatura si accumula nel sistema come Energia potenziale se si evidenziano passaggi di stato e/o sintomi di reazione Le variazioni di temperature sono dunque correlabili all’energia cinetica delle particelle che costituiscono il sistema; i passaggi di stato, evidenti anch’essi a livello macroscopico, si correlano invece a variazioni di energia potenziale del sistema, cioè a modificazioni intime nella struttura della materia. Come vedremo anche i sintomi delle reazioni chimiche evidenziano cambiamenti di energia interna nella forma di energia potenziale, perché coinvolgono direttamente i legami chimici dei reagenti che si rompono per formare nuovi legami chimici nei prodotti. Il contributo dell’enegia potenziale all’energia interna del sistema è maggiore di quello cinetico e, dal momento che l’energia potenziale è negativa (il lavoro per allontanare le particelle che si attraggono è negativo e dunque lo è anche la corrispondente energia ponteniale) mentre quella cinetica è positiva, l’energia interna di un solido è negativa. Per i liquidi si ha una sostanziale equivalenza tra gli effetti di ordine e di disordine. In effetti nei liquidi l’energia potenziale (di legame) dà circa lo stesso contributo (in valore assoluto) di quello dell’energia cinetica. Quindi l’energia interna di un liquido è circa uguale a 0. Nello stato gassoso l’effetto disgregante dell’energia cinetica prevale su quello delle forze di attrazione. Di conseguenza il contributo dell’energia potenziale in valore assoluto è minore diquello dell’energia cinetica. Quindi l’energia interna di un gas è positiva. Nella tabella che segue sono riportati tre indicatori macroscopici che evidenziano un aumento di energia interna nel sistema e che sono stati analizzati in questa sezione. Il quarto indicatore si riferisce all’ aumento di energia interna conseguente ad un aumento di materia nel sistema. Indicatori macroscopici di variazioni di energia interna Variazioni di temperatura Un corpo caldo ha più energia accumulata di uno freddo Variazioni di fase Il vapore a 100 °C ha più energia accumulata dell’acqua liquida alla stessa temperatura Variazioni di composizione A temperatura ambiente i reagenti di questa reazione hanno più energia interna dei loro prodotti alla stessa temperatura Variazioni di massa Un sistema la cui massa aumenta, accumula l’energia interna associata all’incremento di massa. Esercizi 1) in che forma di energia si trasforma il calore assorbito durante il riscaldamento di una sostanza? a) prima della sosta termica si trasforma in ……………………………………………………… b) durante la sosta termica si trasforma in ……………………………………………………….. c) dopo la sosta termica si trasforma in ………………………………………………………….. 2) esamina le seguenti grandezze durante il riscaldamento e il raffreddamento di una sostanza e completa correttamente la tabella riscaldamento temperatura calore sosta termica raffreddamento aumenta assorbito (detto sensibile) velocità delle particelle viene detto latente inalterata posizioni delle particelle 3) perché il calore latente di solidificazione di una sostanza coincide con il suo calore latente di fusione? Quale principio verrebbe violato se così non fosse? ……………………………………………………………………………………………………………….. ……………………………………………………………………………………………………………….. ……………………………………………………………………………………………………………….. Soluzioni: 1) energia cinetica, energia potenziale, energia cinetica 2) costante, diminuisce; ceduto; aumenta, diminuisce; si allontanano, si avvicinano 3) verrebbe violato il principio di conservazione dell’energia