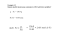1 5) Una soluzione acquosa di idrossido di sodio NaOH al 32% m/m
Transcript
1 5) Una soluzione acquosa di idrossido di sodio NaOH al 32% m/m
1) Considerando una mole di carbonato di calcio (massa=100g) e una mole di solfato di bario (massa=233 g), si può affermare che: a) La mole di carbonato di calcio è più leggera perché contiene un minore numero di molecole. b) La mole di solfato di bario contiene un maggior numero di molecole, essendo più pesante di quella di carbonato di calcio. c) Nonostante la differenza di massa, le due moli contengono lo stesso numero di molecole. d) Non ha alcun senso confrontare le moli di sostanze diverse. 2) Quante molecole sono contenute in 500 g di CaCO3 puro? PM =100 moli= Massa/PM n molecole = moli * N molecole CaCO3 = moli * numero di Avogadro = ( 500g/100).6,023*1023= 3) Quante molecole H2 di idrogeno gassoso sono presenti in 2 g di idrogeno? a) 1 b) 2 c) 6,023 d) 6,023* 1023 moli = massa/ PM molecole = moli * A moli= 2g/2=1 molecole=1*6,023*1023=6,023*1023 4) Quale volume occupano 4 g di idrogeno a 0°C e alla pressione atmosferica? a) 4 cm3 b) 22,4 dm3 c) 44,8 dm3 d) 44,8 cm3 1 mole = 22,4 L moli= massa/PM moli= 4g/2= 2 3 2 moli * 22,4 L = 44,8 L = 44,8 dm 5) Una soluzione acquosa di idrossido di sodio NaOH al 32% m/m ha densità 1,35g/cm3. Calcola il volume di soluzione che contiene 0,5 moli di idrossido di sodio 1^ modo: 1 Si deve calcolare la molarità della soluzione,applicando la formula: M= %. D. 10 PM = 32 . 1,35 . 10 = 10,8 M 40 Si applica la formula inversa V = moli/M = 0,5/10,8 = 0,046 L = 46mL gNaOH = 0,5 x 40 = 20 ; 32 : 100 = 20 : gsoluz. ; grammi di soluzione = 20 x 100 / 32 = 62,5 1,35 : 1 mL = 62,5 : V soluz. ; V soluz. = 62,5 / 1,35 =46,3 mL ------------------------------------------------------------------------------------------------------6. Ad un cilindro graduato che contiene 20ml di una soluzione 0,15 M viene aggiunta acqua distillata fino al volume di 50 ml. Calcolare la molarità della nuova soluzione M2. Si applica la seguente uguaglianza: le moli della soluzione 1 sono uguali alle moli della soluzione 2 M1 x V1= M2 x V2 0,02 x 0,15 = M2 x 0,05 ; M2 = 0,02 x 0,015 = 0,06 M 0,05 2