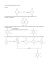Chimica organica e biochimica IV anno biotecn san
Transcript
Chimica organica e biochimica IV anno biotecn san
I.I.S.S. “BOSCARDIN” – VICENZA A.S. 2016/2017 CHIMICA MATERIALI E BIOTECNOLOGIE Articolazione: BIOTECNOLOGIE SANITARIE Programmazione di dipartimento di CHIMICA ORGANICA E BIOCHIMICA Classe QUARTA *saperi di base CONTENUTI CONOSCENZA ABILITA’/CAPACITA’ Ripasso concetti fondamentali della chimica organica trattati nella classe III. Riportare i raggruppamenti atomici che caratterizzano i gruppi funzionali studiati*. Interazioni intermolecolari. Proprietà fisiche delle molecole organiche*. Rappresentare con formule di struttura complete e condensate molecole organiche*. Individuare nelle formule di struttura i gruppi funzionali studiati l’anno scorso. * Correlare le interazioni intermolecolari con i gruppi funzionali presenti nelle molecole.* Far uso di formule di struttura*. Applicare le principali regole della nomenclatura IUPAC.* Struttura e classificazione delle ammine*. Proprietà fisiche delle ammine*. Ammine naturali. Reattività: basicità*, nucleofilicità*. N-nitrosammine. Classificare le ammine in base alla struttura*. Dalla struttura al nome IUPAC e viceversa*. Individuare il tipo di interazione intermolecolare sulla base della struttura molecolare*. Mettere in relazione le proprietà fisiche con l’intensità delle interazioni intermolecolari. Riportare l’equazione chimica che evidenzia la basicità delle ammine*. Motivare la diversa basicità delle ammine sulla base di effetti induttivi, effetti mesomerici ed effetti sterici. Riportare l’equazione chimica delle ammine in cui si evidenzia il carattere nucleofilo dell’azoto*. (alchilazione esauriente con produzione di sale di ammonio quaternario). Distinguere le aldeidi dai chetoni sulla base della struttura*. Dalla struttura al nome IUPAC e viceversa*. Individuare il tipo di interazione intermolecolare sulla base della struttura molecolare*. Mettere in relazione le proprietà fisiche con l’intensità delle interazioni intermolecolari*. Individuare il numero di ossidazione degli atomi di carbonio in una formula di struttura*. Motivare la particolare reattività degli atomi del carbonile sulla base degli effetti elettronattrattori dell’ossigeno e sulla distribuzione della carica elettrica che ne deriva. Riportare la reazione generale di addizione nucleofila al carbonile* Riportare e descrivere il meccanismo di reazione di addizione nucleofila al carbonile. Riportare il meccanismo di addizione di alcoli con formazione di semiacetali e acetali*. Comparare la reattività di aldeidi e chetoni 3 ore Ammine 6 ore Aldeidi e chetoni. 15 ore Ibridazione del carbonio carbonilico e geometria del carbonile*. Polarità del carbonile*. Aldeidi e chetoni*. Nomenclatura*. Proprietà fisiche*. Preparazione: ossidazione di alcoli primari e secondari* Reattività del carbonile*. Addizione nucleofila*. Addizione di alcoli* e tioli. Addizione di HCN. Addizione di composti azotati. Tautomeria cheto-enolica. Acidi carbossilici e derivati 15 ore Stereochimica 15 ore Carboidrati 15 ore Struttura chimica del gruppo carbossilico*. Nomenclatura IUPAC*. Nomenclatura comune solo di acidi di interesse biologico* (es: ossalico, malonico, succinico, malico,tartarico, lattico, piruvico, citrico). Nomenclatura dei sali derivati dagli acidi.* Proprietà fisiche degli acidi*. Preparazione di acidi per ossidazione di alcoli primari e aldeidi. Reazioni degli acidi: ionizzazione, formazione di sali*. Influenza dei sostituenti sull’acidità. Derivati degli acidi carbossilici: esteri e ammidi*. Reazione di esterificazione. Idrolisi acida e saponificazione degli esteri e delle ammidi.* L’atomo di carbonio asimmetrico.* Enantiomeri*. Molecole chirali.* Attività ottica*. Luce polarizzata nel piano*. Miscela racemica*. Polarimetro*. Misure di α *(laboratorio) Diastereoisomeri e forme meso. Proiezioni di Fischer*. Regole di priorità di Cahn, Ingold e Prelog*. Configurazione assoluta R/S*. Gliceraldeide come standard per le configurazioni relative D e L*. Saper dove sono diretti i legami orizzontali e verticali, rispetto all’osservatore, in una proiezione di Fischer*. Sapere le regole per costruire le proiezioni di Fischer di D e L gliceraldeide.* Conoscere il significato dei simboli (+), (-), D, L, R, S nell’ambito della stereochimica.* Caratteristiche generali dei carboidrati*. Definizione*. Classificazione*. Sapere l’origine del nome carboidrato. D e L zuccheri*. Epimeri*. Struttura ciclica dei monosaccaridi*. C anomerico*. Anomeri α e β*. Mutarotazione.* Ossidazione*. Monosaccaridi principali: Glucosio*, Fruttosio*, ribosio*. Sapere che glucosio/ fruttosio si trasformano in emiacetali/ emichetali a struttura ciclica*. Disaccaridi e legame glicosidico (acetali): maltosio*, cellobiosio*, lattosio, saccarosio*. Conoscere l’origine e le principali caratteristiche di disaccaridi. Omopolisaccaridi: amido, glicogeno, cellulosa. Conoscere la distribuzione in natura e la funzione di amido, glicogeno e cellulosa.* Sapere con quale tipo di legame sono uniti nel polimero le unità monomeriche*. motivandola sulla base di effetti elettrondonatori e sterici. Riportare i prodotti di addizione del carbonile con ammoniaca, ammine. Distinguere le aldeidi dai chetoni sulla base della struttura*. Dalla struttura al nome IUPAC e viceversa*. Individuare il tipo di interazione intermolecolare sulla base della struttura molecolare*. Mettere in relazione le proprietà fisiche con l’intensità delle interazioni intermolecolari*. Individuare il numero di ossidazione degli atomi di carbonio in una formula di struttura*. Individuare i centri stereo geni all’interno di una molecola*. Classificare le molecole come chirali o achirali*. Descrivere il raggio di luce ordinario e quello polarizzato nel piano*. Descrivere il polarimetro e le funzioni dei vari componenti. Risolvere semplici problemi utilizzando α [ α ]20 D= l⋅c l’equazione Sapere quali tipi di molecole possono dare luogo a diasteroisomeri e quali caratteristiche deve avere il dia stereoisomero per essere una forma meso. Identificare il centro stereogeno in una proiezione di Fischer*. Individuare la priorità di un atomo o di semplici gruppi atomici*. Data una proiezione di Fischer ricavare la configurazione assoluta del centro stereogeno e percorso inverso*. Riconoscere i gruppi funzionali caratteristici dei carboidrati*. Classificare un carboidrato in aldoso o chetoso*. Applicare le regole della numerazione IUPAC della catena carboniosa dei carboidrati*. Costruire l’albero genealogico e classificare un carboidrato come D o come L*. Rappresentare l’equilibrio chimico del glucosio e del fruttosio, sia mediante formule di Fischer-Tollens sia con le proiezioni di Haworth.* Associare il fenomeno della mutarotazione a fenomeni chimici.* Riportare i prodotti di reazione di monosaccaridi rappresentativi con ossidanti forti e ossidanti blandi. Rappresentare e riportare le formule di Haworth dei disaccaridi.* Classificare un disaccaride in riducente in base alla struttura chimica.* Associare le proprietà fisiche dei polisaccaridi Amminoacidi, peptidi e proteine. 15 ore Lipidi 15 ore Caratteristiche generali degli amminoacidi*. D e L amminoacidi*. Classificazione degli amminoacidi in base alla natura del gruppo R.* Proprietà fisiche*. Proprietà anfotere*. Carica elettrica dell’amminoacido e pH*. Zwitterione*. Punto isoelettrico.* Ossidazione della cisteina a cistina*. Legame peptidico*. Convenzione nel riportare la sequenza degli amminoacidi nei peptidi*. Caratteristiche del legame peptidico e struttura spaziale dei peptidi*. Classificazione dei lipidi: in base alla funzione e in base alla reazione di saponificazione*. Acidi grassi naturale saturi e insaturi*. Proprietà fisiche in relazione con la struttura.* Lipidi saponificabili*. Sapere quali legami rendono un lipide saponificabile*. Gliceridi*. Proprietà fisiche*. Oli e grassi.* Reazione di saponificazione*. Saponi e micelle. Fosfolipidi*. Funzione biologica*. Struttura*. Classificazione*. Micelle. Doppi strati lipidici. Cere. Lipidi in saponificabili*. Struttura di tipo isoprenico. Terpeni. Steroidi*. Vitamine liposolubili*. Conoscere, a grandi linee, le funzioni dei lipidi insaponificabili. con la struttura molecolare e sopramolecolare dei polisaccaridi.* Individuare i gruppi funzionali che caratterizzano gli amminoacidi e il centro stereogeno*. Riportare le proiezioni di Fischer di D e L amminoacidi*. Classificare gli amminoacidi in apolari, polari neutri, acidi e basici*. Riportare gli equilibri chimici che evidenziano il passaggio dalla forma cationica alla forma anionica come conseguenza dell’aggiunta di alcali*. Individuare lo ione dipolare e dedurne le proprietà elettriche.* Definire il punto isoelettrico*. Riportare il comportamento di un aa posto in un C.E. quando il pH della soluzione è = pI, qando il pH>pI e quando pH<pI. Riportare le forme limite di risonanza del legame peptidico e dedurre la reale struttura*. Individuare, a partire dalla formula di struttura, se un lipide è saponificabile.* Riportare la formula di struttura di acidi grassi saturi e insaturi*. Descrivere come varia Tf degli acidi grassi saturi all’aumentare del n° di atomi di C*. Motivare la differenza in Tf tra un acido grasso saturo e uno insaturo con lo stesso n° di C*. Riportare le formule di struttura di mono, di e triacilgliceroli*. Prevedere le proprietà fisiche dei triacilgliceroli in base alla composizione in acidi grassi*. Riportare la reazione di saponificazione dei triacilgliceroli*. Definire un sapone* e descrivere la struttura di una micella di sapone. Mettere in relazione la struttura della micella con le interazioni intermolecolari che la stabilizzano. Descrivere il meccanismo dell’azione detergente dei saponi. Riportare la formula di struttura di un fosfogliceride e individuare i tipi di legami che uniscono le varie parti della molecola*. Riportare i prodotti di saponificazione di un fosfogliceride*. Individuare le porzioni polari e quelle apolari sapendo motivare le scelte*. Descrivere la struttura di una micella e di un doppio strato*. Descrivere la struttura di un liposoma. Conoscere la localizzazione cellulare dei fosfogliceridi e le proprietà delle strutture che originano*. Definire, dal punto di vista molecolare, una cera. Riportare la struttura base che caratterizza tutti gli steroidi*. 99 ore totali comprendenti le lezioni e le attività di laboratorio, le ore da dedicare a verifiche scritte e orali e alle attività di recupero (per le quali sono previste circa 6 ore). LABORATORIO Si prevede lo svolgimento di esperienze connesse con i contenuti teorici sviluppati nei moduli suindicati, riguardanti ad esempio: tecniche di separazione e di purificazione, analisi qualitativa, determinazione di proprietà fisiche, sintesi di composti organici. In particolare sono state concordate in dipartimento le seguenti esperienze: Ripasso ed eventuale esecuzione di esperienze del terzo anno non svolte Riconoscimento di aldeidi con i reattivi: Fehling, Benedict e Tollens Reazione di saponificazione Esterificazione: sintesi dell’aspirina. Esterificazione: sintesi dell'acetato di isoamile (facoltativo) Saggi per il riconoscimento degli zuccheri riducenti: Fehling, Benedict e Tollens. Idrolisi acida del saccarosio (zucchero invertito). Uso del polarimetro. Costruzione di curva di taratura polarimetrica del saccarosio. Riconoscimento dei polisaccaridi con il reattivo di Lugol. Idrolisi acida dell'amido. Ricerca dei lipidi negli alimenti con il reattivo Sudan III (facoltativo) Proteine: Determinazione del P.I. della caseina.(punto isoelettrico), Denaturazione con acidi organici e metalli pesanti. Cromatografia degli amminoacidi L’attività di laboratorio si propone in questa disciplina il raggiungimento dei seguenti obiettivi: (*contenuti e abilità da conseguire per il livello base) Conoscere e applicare le norme di sicurezza nel laboratorio chimico;* Conoscere e saper utilizzare strumenti di laboratorio e vetreria;* Individuare e gestire le informazioni per organizzare le attività sperimentali;* Effettuare l’elaborazione dati delle esperienze proposte;* Interpretare dati e risultati sperimentali in relazione a semplici modelli teorici di riferimento;* Redigere relazioni tecniche e documentare le attività individuali e di gruppo relative a situazioni professionali;* Controllare progetti e attività, applicando le normative sulla protezione ambientale e sulla sicurezza