Spettroscopia UV
Transcript
Spettroscopia UV
Spettroscopia UV
L'assorbimento di una molecola nell'UV e nel visibile riguarda transizioni elettroniche degli
elettroni di legame e dipende dalla struttura elettronica della molecola. A temperatura ambiente,
praticamente tutte le molecole di un composto organico si trovano nello stato fondamentale, cioè
quello a più bassa energia.
Se consideriamo gli elettroni di legame, nello stato fondamentale essi occupano gli orbitali di più
bassa energia disponibili rispettando il principio di esclusione di Pauli (2 elettroni per orbitale).
Quindi gli orbitali di legame di tipo e (per molecole insature) di tipo π saranno completamente
occupati, così come quelli di non legame (n) per molecole con etereoatomi come N e O; gli orbitali
di antilegame e π* saranno invece vuoti (in caso di radicali o carbocationi la situazione non è
esattamente questa). In generale, poiché i legami σ sono i più forti, gli orbitali σ sono quelli ad
energia più bassa, ed i relativi orbitali σ* quelli ad energia più alta; gli orbitali di non legame, non
coinvolto in legami, saranno ad energia intermedia tra gli orbitali di legame e di antilegame.
Quindi, a grandi linee, l'energia degli orbitali disponibili in una molecola organica può essere
descritto così:
E
σ*
π*
n
π
σ
Una transizione elettronica consiste nello spostamento di un elettrone da un orbitale ad un altro, e
questo per una molecola organica nello stato fondamentale può avvenire principalmente in tre
modi: da un orbitale σ ad uno σ* (transizione σ→σ*), da un orbitale π ad uno π* (transizione
π→π*), e da un orbitale n ad uno π* (transizione n→π*).
Nella pratica, per molecole organiche le transizioni che riguardano i legami σ (transizioni σ→σ*)
cadono nella regione del lontano UV, cioè al di sotto dei 190 nm, poiché la differenza di energia tra
i due livelli è piuttosto elevata. Questa regione non è accessibile dai normali strumenti, perché, tra
l'altro, anche l'aria assorbe a queste lunghezze d'onda. Per questo, la spettroscopia UV è utile
soprattutto per molecole insature (transizioni π→π* e n→π*), e particolarmente per quelle con
doppi legami coniugati.
Un gruppo funzionale insaturo capace di assorbire all'UV viene detto cromoforo. La lunghezza
d'onda dell'assorbimento può variare se è esso è legato a gruppi funzionali con elettroni di non
legame: questi gruppi funzionali, che di per sé non assorbono, ma influenzano l'assorbimento di
cromofori, sono detti auxocromi. Altri termini usati nel campo della spettroscopia UV sono: lo
spostamento dell'assorbimento verso lunghezze d'onda maggiori (dovuto a sostituenti sul
cromoforo, a variazioni del solvente, o a variazioni del pH) è detto shift batocromico, o
spostamento verso il rosso; lo spostamento verso lunghezze d'onda minori è detto shift
ipsocromico, o spostamento verso il blu. Un aumento dell'ε è detto effetto ipercromico, mentre la
sua diminuzione è detto effetto ipocromico.
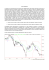
Un tipico spettro UV è qui rappresentato:
Come si vede, le bande di assorbimento sono piuttosto larghe, e radiazioni in un range anche di
decine di nm possono eccitare la stessa transizione elettronica. Come è possibile questo, se abbiamo
detto che sono un fotone che ha un energia esattamente pari alla differenza di energia tra due livelli
può essere assorbito? In realtà bisogna considerare che molecole nello stesso stato elettronico
possono trovarsi in diversi stati vibrazionali e rotazionali (vedi figura):
Se comprendiamo nell'energia totale della molecola anche i livelli vibrazionali e rotazionali,
vediamo che sono possibili molte transizioni, di energia simile ma non identica, che portano dallo
stesso stato fondamentale allo stesso stato eccitato. Sono particolarmente importanti gli stati
vibrazionali dello stato elettronico eccitato: infatti a temperatura ambiente quasi tutte le molecole,
oltre ad essere nello stato fondamentale elettronico, sono anche nello stato fondamentale
vibrazionale; ma non è affatto detto che la transizione più probabile sia quella che porta allo stato
vibrazionale fondamentale dello stato elettronico eccitato. In effetti la geometria a minima energia
dello stato eccitato può essere piuttosto diversa da quella dello stato fondamentale, ma le transizioni
elettroniche sono molto veloci, e durante l'eccitazione la molecola non ha tempo di variare la sua
geometria (questo è noto come principio di Frank-Condon). Quindi la molecola, dopo l'eccitazione,
viene a trovarsi in uno stato elettronico eccitato, e con una conformazione molto diversa da quella
di minima energia, cioé in uno stato vibrazionale ad energia piuttosto elevata.
In alcuni casi lo spettro UV presenta delle ondulazioni, con molti massimi corrispondenti alle varie
transizioni tra diversi livelli vibrazionali; questo accade soprattutto allo stato gassoso e in solventi
poco polari: si parla allora di struttura fine della banda:
Più spesso la presenza di energia rotazionale porta alle sovrapposizione dei vari livelli vibrazionali,
e allora la transizione dà luogo ad un unica, larga banda.
Nello studiare uno spettro UV, noi andiamo a guardare la lunghezza d'onda in cui l'assorbimento è
massimo (detta λmax), e la corrispondente assorbanza specifica molare (detta εmax). Anche se la λmax
non corrisponde esattamente alla differenza di energia tra i livelli elettronici (esclusi cioè le energie
vibrazionali e rotazionali), è un dato facilmente accessibile sperimentalmente, e che è stato messo
in relazione con la struttura della molecola. Talvolta accade che due bande dovute a due diverse
transizioni siano parzialmente sovrapposte, e la banda più debole non presenti più un vero e proprio
massimo, ma dia luogo ad una "spalla" sulla banda più debole:
In questo caso si individua il punto di flesso dello spettro (punto in cui la derivata 2a dello spettro è
nulla, e la derivata 1a è massima o minima) e si riporta la λ e l'ε di questo punto, aggiungendo la
dicitura "spalla" (inglese "shoulder") a questi dati.
Strumentazione
La cuvetta UV è costruita in quarzo, in modo da essere trasparente da 190 a 780 nm. La più
comune è a forma di parallelepipedo, e misura 1 cm ( 1 cm, con altezza di circa 4 cm. Essa quindi
ha un cammino ottico di 1 cm e può contenere circa 3 ml di soluzione. Le cuvette possono anche
avere un cammino ottico minore, fino a 1 mm, per l'uso con soluzioni concentrate, o maggiore per
l'uso con soluzione diluite; esistono anche speciali cuvette con specchi che possono avere un
cammino ottico anche di 1 m. In generale, per la massima precisione della misura bisogna scegliere
una concentrazione e un cammino ottico tale che il massimo di assorbanza sia compreso tra 0.1 e 1.
Assorbanze troppo basse fanno sì che I e I0 siano troppo simili, e quindi e quindi anche un piccolo
errore nella loro misura provochi un grande errore percentuale nell'assorbanza. Assorbanze troppo
grandi fanno sì che I sia molto piccolo, e quindi difficile da misurare con precisione. In generale la
massima assorbanza misurabile con una certa affidabilità è intorno a 2, e il valore massimo in molti
strumenti è di 3 (che significa che I0/I è pari a 1000!).
Importante è anche la scelta del solvente. Tutti i solventi usati comunemente non hanno transizioni
nel vicino UV (λ > 190 nm). Tuttavia abbiamo visto che le bande UV sono larghe, e anche
transizioni che hanno massimi nel lontano UV possono avere code nel vicino UV. Certo, l'uso della
cella di riferimento tiene conto dell'assorbimento del solvente, ma se il solvente assorbe troppo
l'assorbimento del campione (che è sempre molto di meno) viene nascosto. Per questo ogni
solvente ha una lunghezza d'onda minima, al di sotto della quale non può essere usato. I solventi
migliori da questo punto di vista sono l'acqua e l'acetonitrile, che sono sufficientemente trasparenti
fino a 190 nm. Altri solventi usati comunemente sono il n-esano, l'isoottano, e l'etanolo al 95% (il
resto è acqua). Ecco una grafico delle lunghezze d'onda limite per vari solventi:
Assorbimento UV caratteristici di varie classi di composti organici
Alcani. Gli alcani hanno solo legami σ e non hanno coppie di elettroni di non legame. Per questo
sono trasparenti all'UV a tutte le lunghezze d'onda.
Composti saturi contenenti eteroatomi. Questi composti (alcoli, eteri, ammine, tioli, solfuri)
possono avere transizioni n→σ*, di energia minore rispetto alle σ→σ*. Tuttavia questi
assorbimenti cadono ancora nel lontano UV, o al limite intorno ai 200 nm, per cui sono di scarsa
utilità pratica.
Alcheni. Gli alcheni isolati (= non coniugati) possono presentare transizioni di tipo π→π*, ma
assorbono ancora nel lontano UV. Per esempio l'etilene ha una λmax di 165 nm. Tuttavia
l'assorbimento di alcheni più sostituiti (con gruppi alchilici) si sposta verso lunghezze d'onda più
alte (shift batocromico), probabilmente per effetto dell'ipeconiugazione tra gli orbitali vuoti π* e gli
orbitali σ di gruppi alchilici, che abbassa l'energia dei primi. Anche eteroatomi direttamente legati
al doppio legame possono dare notevoli shift batocromici (in particolare l'azoto e lo zolfo) a causa
della possibilità di coniugazione. Il metilvinilsolfuro, per esempio, assorbe nel vicino UV con λmax
di 228 nm.
Gli alcheni coniugati assorbono invece nel vicino UV, a lunghezze d'onda tanto maggiori quanto
più grande è il numero di doppi legami coinvolti nella coniugazione. Infatti se si ha coniugazione
gli orbitali π di legame sono estesi all'intero sistema coniugato, ed assumono diverse energie. Per
esempio nell'1,3-butadiene abbiamo 4 orbitali molecolari ad energia crescente:
π4*
π*
π3*
π2
π
π1
etilene
1,3-butadiene
La differenza di energia tra l'orbitale π2 e quello π3* è molto minore che tra gli orbitali π e π*
dell'etilene, per cui il butadiene assorbe nel vicino UV, a 217 nm. In un triene, la transizione
avverrebbe tra livelli ancora più vicini e quindi a lunghezze d'onda ancora maggiori. Le bande di
assorbimento di tipo π(π* in composti coniugati sono chiamate bande K, dal tedesco konjugierte.
Le bande K sono generalmente molto intense, con εmax dell'ordine di 104.
L'utilità della spettroscopia UV nello studio di polieni coniugati nasce dal fatto che sono state
trovate alcune regole empiriche che permettono di prevedere in maniera piuttosto accurata la λmax.
Si è visto sperimentalmente che la λmax dipende da:
• numero di doppi legami, come già visto;
• sostituenti sul sistema coniugato (alchilici e non), con effetti simili a quelli descritti per
l'etilene;
• presenza di cicli.
Quest'ultimo fattore dipende dal fatto che un diene può assumere due conformazioni, s-cis e strans. La s-trans è più stabile in alcheni aciclici, perché nella s-cis ci sono interazioni steriche
sfavorevoli.
H
H
H
H
H
H
H
H
H
H
H H
In un diene ciclico, però, il diene è necessariamente in conformazione s-cis se i due doppi legami
sono nello stesso ciclo (diene omoannulare); questo non è invece necessariamente vero se i due
doppi legami sono su cicli diversi (diene eteroannulare):
Diene omoannulare
Diene eteroannulare
Si è visto sperimentalmente (le ragioni teoriche non sono chiare) che un diene omoannulare assorbe
a λmax notevolmente più lunghe di un diene eteroannulare o semplicemente aciclico. Anche l'εmax di
un diene omoannulare (εmax < 10000) è generalmente inferiore a quella di un diene eteroannulare o
aciclico (εmax > 10000).
Le regole empiriche trovate per polieni coniugati sono dette regole di Woodward-Fieser, e sono
regole additive: il valore di base è 214 nm per un diene eteroannulare o lineare, e 253 nm per un
diene omoannulare. Ogni ulteriore doppio legame estendente la coniugazione aumenta la λmax di 30
nm. Tuttavia, questa regola non vale per composti come:
in cui il sistema coniugato non è lineare, ma ramificato. Per questi composti, detti "crossconjugated" (con coniugazione incrociata) non è facile prevedere la λmax. Ogni sostituente alchilico
sul sistema coniugato fa crescere la se uno dei doppi legami è esociclico, come in:
la λmax aumenta di ulteriori 5 nm. Sostituenti contenenti eteroatomi hanno effetti diversi. Infine, la
λmax è poco o per niente influenzata dalla polarità del solvente (al contrario di quello che accade per
i composti carbonilici α,β-insaturi). Le regole possono essere riassunte in questo schema:
Regole di Woodward-Fieser per i dieni coniugati
Valore di base:
dieni eteroannulari
214 nm
dieni omooannulari
253 nm
Sostituenti
Incrementi:
Ulteriore C=C
30 nm
Gruppo alchilico
5 nm
C=C esociclico
5 nm
OAc
0 nm
OAlchile
6 nm
SAlchile
30 nm
Cl o Br
5 nm
N(Alchile)2
60 nm
Le regole di Woodward e Fieser sono applicabili a polieni che comprendono fino a 4 doppi legami.
Per polieni con un numero maggiore di doppi legami esistono altre regole per calcolare
l'assorbimento, che non verranno qui trattate, ma che comunque prevedono un aumento della λmax e
dell'εmax all'aumentare del numero dei doppi legami. Alcuni polieni naturali con coniugazione
estremamente estesa assorbono a lunghezze d'onda così alte da arrivare nel visibile, e con ε elevati,
e sono quindi fortemente colorati. Fra di essi ricordiamo il β-carotene (il colorante arancione della
carota) che ha 11 doppi legami coniugati, ed è arancione (λmax 452 nm, ε 152000):
ed il licopene (il rosso del pomodoro), anch'esso con 11 doppi legami coniugati(λmax 474 nm, ε
186000):
Aldeidi e chetoni. Il gruppo carbonilico presenta, oltre al legame π, due coppie di elettroni di non
legame. Esso perciò avrà due possibili transizioni: quella di tipo π→π*, che per un composto
carbonilico non coniugato cade nel lontano UV (λmax intorno a 150 nm), ed è simile a quella
osservata per l'etilene; ed una transizione n→π*, che per la maggiore energia degli elettroni in
orbitali di tipo n cade nel vicino UV, in genere tra i 270 ed i 300 nm. Tuttavia questa transizione
(chiamata banda R, dal tedesco radikalartig, cioè radicalica) è molto debole, con ε minore di 30. in
effetti, la transizione sarebbe una transizione non possibile ("proibita") secondo le regole della
quantomeccanica, poiché gli orbitali n e π* hanno diversa simmetria. Essa in realtà non è del tutto
impossibile, come è dimostrato dalla presenza della banda R, poiché le vibrazioni della molecola
possono influenzare la simmetria del carbonile, ma comunque ha una probabilità molto bassa e
perciò da luogo a una banda molto debole. La della banda R di un chetone risente della natura dei
gruppi alchilici legati al carbonile, ma non permette di ricavare importanti informazioni strutturali;
è inoltre molto spesso nascosta da transizioni più intense. È tuttavia importante nello studio della
stereochimica delle molecole, perché dà luogo a spettri di dicroismo circolare (una tecnica correlata
all'UV) la cui interpretazione può fornire informazioni su configurazione e conformazione di alcuni
tipi di chetone. Anche se i due CO di un α-dichetone sono formalmente coniugati tra loro, in effetti
il loro assorbimento UV è simile a quello di chetoni non coniugati.
Aldeidi e chetoni α,β-insaturi. Il sistema π di un enone è simile a quello di un diene, per cui anche
aldeidi e chetoni α,β-insaturi presentano intense bande K (relative a transizioni π→π*) nel vicino
UV; le tipiche λmax vanno da 215 a 250 nm. Inoltre, è presente la debole banda R dovuta alle
transizioni n→π* dei doppietti elettronici dell'ossigeno, che è spostata a lunghezze d'onda più
elevate (300-330 nm) rispetto ai composti carbonilici non coniugati per la minore energia del primo
orbitale π*.
Anche per aldeidi e chetoni α,β-insaturi, come per i dieni, sono state trovate relazioni empiriche tra
struttura e λmax (ancora una volta per merito di Woodward e Fieser) simile a quelle descritte per i
dieni. Ci sono però due importanti differenze: mentre un sostituente su un diene esercita più o meno
la stessa influenza in ogni posizione del sistema coniugato, per un enone l'influenza è differente se
il sostituente è legato all'atomo di carbonio α, a quello β, o, per sistemi con ulteriori doppi legami,
in posizioni successive (γ,δ, ecc.):
β
O
δ
R
α
γ
Questo succede perché il doppio legame C=O è molto più polarizzato di quello di quello di un
alchene, e anche le posizioni α e β risultano avere, per risonanza, densità elettroniche piuttosto
diverse. Quindi un sostituente può perturbare l'energia dei vari orbitali molecolari in maniera
diversa a seconda dell'atomo a cui è legato.
Un altro effetto dovuto alla polarità del legame C=O è l'influenza del solvente sulla λmax delle
transizioni R e K di un enone: un solvente più polare fa diminuire la λmax della transizione R (shift
ipsocromico), mentre fa aumentare quella della transizione K (shift batocromico).
Regole di Woodward-Fieser per gli enoni:
Valori di base:
Chetoni aciclici
215 nm
Chetoni ciclici a 6 termini
215 nm
Chetoni ciclici a 5 termini
202 nm
Aldeidi (acicliche)
210 nm
Acidi ed esteri (aciclici)
195 nm
Sostituenti
Incrementi:
Ulteriore C=C
30 nm
10 nm
Gruppo alchilico
α
12 nm
β
18 nm
γ, δ
C=C esociclico
5 nm
C=C omodienici
39 nm
35 nm
OH
α
30 nm
β
50
nm
δ
6 nm
OAc
α, β, δ
35 nm
OMe
α
30 nm
β
17 nm
γ
31 nm
δ
Sostituenti
SAlchile
Cl
Br
N(Alchile)2
Solvente
Etanolo
Metanolo
Diossano
Cloroformio
Etere
Acqua
Esano
Cicloesano
α
β
α
β
β
Incrementi:
85 nm
15 nm
12 nm
25 nm
30 nm
95 nm
Correzione
0 nm
0 nm
-5 nm
-1 nm
-7 nm
+8 nm
-11 nm
-11 nm
Come si può notare, in questo caso anche il gruppo OH è tra i possibili sostituenti di un sistema
enonico, cosa che non succedeva con i polieni. Questo perché i composti 1,2- e 1,3-dicarbonilici
esistono in parte o completamente in forma enolica, ed è proprio l'enolo (con il C=C coniugato al
chetone residuo) che assorbe all'UV.
O
H
O
I composti con cross conjugation (il CO è coniugato a due doppi legami non coniugati tra loro) si
comportano in maniera anomala, ed assorbono in maniera più simile a enoni che a dienoni.
Benzene e derivati. Nel benzene i 6 orbitali p dei sei carboni si combinano tra di loro per dare
orbitali molecolari estesi all'intera molecola: si formano 3 orbitali di legame π e 3 orbitali di
antilegame π*. Sono quindi possibili varie transizioni π→π*. In particolare, il benzene presenta 3
bande di assorbimento, a λmax 184 (ε = 60.000), 204 (7900) e 254 (200). Le tre bande sono
chiamate rispettivamente banda E1, E2, e B. La banda B del benzene e di molti suoi derivati
presenta spesso una ben visibile struttura fine. in particolare in solventi non polari.
Le bande più interessante dei derivati benzenoidi sono la banda B, che cade nel vicino UV, e la
banda E2 può spostarsi nel vicino UV. Sostituenti alchilici sull'anello benzenico (in particolare il
metile) causano un leggero shift batocromico della banda B, che aumenta all'aumentare del numero
dei sostituenti, fino all'esametilbenzene che assorbe a λmax 272. Uno shift batocromico più rilevante
è dato da gruppi auxocromici come OH o NH2, che sono elettron donatori per risonanza; essi
provocano anche un aumento dell'intensità della banda B (fino a ε = 3500 per lo ione fenato).
Anche la banda E2 subisce uno shift batocromico con questi sostituenti, e diventa quindi
nettamente collocata nel vicino UV.
Un aspetto interessante degli spettri UV di derivati fenolici e anilinici è la loro dipendenza dal pH.
L'ossidrile fenolico è piuttosto acido (pKa ≈9) e può essere deprotonato da basi acquose o alcoliche
diluite. Il risultante ione fenato ha bande B ed E2 molto (15-25 nm) spostate a lunghezze d'onda
maggiori, perché l'O– è un elettrondonatore molto migliore dell'OH. Quindi, uno shift batocromico
per aggiunta di base è un buon indizio di una struttura fenolica.
Le aniline, al contrario, sono leggermente basiche, e possono essere convertite nei relativi cationi
per aggiunta di acidi diluiti. Una volta protonato, il gruppo amminico non ha più una coppia di
elettroni da donare all'anello aromatico, per cui lo spettro UV dell'anilina protonata diventa molto
simile a quello del benzene. Quindi, uno shift ipsocromico per aggiunta di acidi è un buon indizio
di una ammina aromatica.
Esempi di assorbimento di benzeni sostituiti:
Banda E2
Composto
λmax
ε
Benzene
204
7.900
Clorobenzene
210
7.600
Tiofenolo
236
10.000
Anisolo
217
6.400
Fenolo
210.5
6.200
Fenato
235
9.400
o-Catecolo
214
6.300
o-Catecolato
236.5
6.800
Anilina
230
8.600
Catione anilinio
203
7.500
Banda B
λmax
256
265
269
269
270
287
276
292
280
254
ε
200
240
700
1.480
1.450
2.600
2.300
3.500
1.430
160
Quando ad un anello benzenico è legato un doppio legame o un carbonile, la situazione è più
complessa. Il benzene conserva la sua banda B, che anche in questo caso appare spostata
batocromicamente. Compare inoltre una intensa (ε > 10.000) banda K nella regione tra i 200 e 250
nm relativa all'intero sistema coniugato.
Esistono regole empiriche che permettono di prevedere la λmax della banda di assorbimento più
intensa di un benzene sostituito (che è la banda K in benzeni coniugati, o la E2 in benzeni non
coniugati).