introduzione - L`Accademia Ercolanese
Transcript
introduzione - L`Accademia Ercolanese
INTRODUZIONE Nella pratica clinica l’Epatologia e la Gastroenterologia “luminale” sono considerate entità distinte, ma nonostante ciò esistono strette relazioni tra intestino e fegato, già suggerite da una comune origine embriologica (1). Tali relazioni sono sia di natura anatomica che funzionale. Relativamente all’aspetto anatomico, è ben noto il ruolo e l’organizzazione strutturale del sistema portale, grazie al quale la quasi totalità del sangue refluo dal compartimento intestinale, ricco in nutrienti e sostanze di vario tipo e natura, giunge al fegato attivandone le funzioni. Da parte sua il fegato partecipa alla funzione metabolica, assorbitiva ed escretrice dell’intestino mediante la secrezione di bile che permette la digestione dei lipidi, l’assorbimento degli stessi e delle vitamine (A, D, E, K) e l’allontanamento delle sostanze non utili o potenzialmente dannose per l’organismo (2). Il legame funzionale tra l’intestino e il fegato si esplica inoltre grazie a meccanismi di tipo neuro-umorale, attraverso la produzione di ormoni e neurotrasmettitori (colecistochinina, secretina, motilina, sostanza P, neurotensina etc.) che regolano molte delle interazioni tra fegato, sistema biliare e tubo digerente soprattutto in relazione all’ingestione di nutrienti (3). Sulla base di tali premesse risulta facile comprendere come numerose patologie possano determinare, 3 con vari gradi di gravità, un’alterazione dell’asse fisiologico intestino-fegato sia se sono a partenza intestinale, sia epatica. Si potrebbero, infatti, prendere in considerazione almeno tre categorie di condizioni patologiche: a) patologie intestinali che provocano un interessamento epatico (tab1); b) patologie epatiche che hanno ripercussioni a livello intestinale (tab 2); c) condizioni sistemiche che possono interessare in maniera indipendente il fegato e l’intestino che una volta coinvolti in un processo patologico possono essere responsabili di un ulteriore danno, l’uno nei confronti dell’altro (sindrome metabolica, diabete, obesità, malattie alcol correlate etc). Nello studio di tali condizioni patologiche si è iniziato a dare sempre più importanza al ruolo patogenetico della flora batterica intestinale. Rappresentando circa 1-1,5 Kg del peso corporeo, essa costituisce un vero e proprio ecosistema aperto, molto complesso sia per quanto riguarda le relazioni tra batteri e batteri che convivono in un delicato equilibrio, sia per quanto riguarda le relazioni tra batteri e ospite. È chiaro come processi patologici di varia natura possano determinare un’alterazione del normale equilibrio del microbiota intestinale con conseguenze che possono essere tanto banali, quanto importanti; infatti, per il sopravvento di ceppi batterici patogeni, si può determinare il mantenimento, ma anche la progressione dei meccanismi patologici che sottendono la malattia in questione. Su tale 4 base è pertanto nata, dal punto di vista terapeutico, l’idea di modulare la flora batterica attraverso l’uso di vari agenti come gli antibiotici o, più di recente, con la somministrazione orale di probiotici, definiti, secondo le linee guida del Ministero della salute italiano del 2005, microrganismi vivi e vitali che conferiscono benefici alla salute dell’ospite, quando consumati in adeguate quantità, come parte di un alimento o integratore. Tab.1. Correlazione tra patologie intestinali e varie tipologie di danno epatico. T INTESTINO a FEGATO colangite sclerosante, epatite autoimmune, colelitiasi bMalattie infiammatorie intestinali . Malattia celiaca steatosi, fibrosi, infiammazione 1Emocromatosi accumulo di ferro, infiammazione,fibrosi, epatocarcinoma, cirrosi steatosi, steatoepatite Bypass digiuno-ileale 5 Tab.2. Correlazione tra patologia epatica ed alterazioni a livello gastrointestinale. alterazione della motilità intestinale Malattia epatica SIBO conseguenze dell’ipertensione portale (gastropatia, enteropatia, colonpatia ipertensiva) Le patologie epatiche e la flora batterica Le conseguenze che le alterazioni della flora batterica hanno nell’ambito del danno epatico o di quello intestinale sono un’ulteriore prova della stretta relazione che esiste tra queste due importanti componenti del sistema gastrointestinale. L’ipotesi, ad esempio, della correlazione tra malattie intestinali croniche e colangite sclerosante primitiva, coinvolge proprio la flora intestinale già responsabile dell’iniziazione e della perpetuazione dell’infiammazione intestinale (4); attraverso la mucosa infiammata del colon, infatti si verifica un passaggio di fattori di origine batterica, come peptidi ed endotossine capaci, una volta giunti al fegato, di innescare il processo infiammatorio (5). Molto complessi sono i meccanismi attraverso i quali si verifica un’alterazione della flora batterica primitivamente epatica. 6 in corso di patologia In questo ambito possono essere considerati tre gruppi di patologie: la malattia epatica alcol correlata, la malattia epatica non alcol correlata (NAFLD e NASH), la cirrosi epatica e le sue complicanze. Alcol e asse intestino-fegato Il consumo di etanolo sia in modo acuto che cronico è correlato ad una vasta serie di disordini clinici di natura gastrointestinale, quali la pancreatite acuta e cronica, l’ampio spettro di epatopatie, i disordini dell’assorbimento dei nutrienti fino ad uno stato di palese malnutrizione, sia di natura extraintestinale (cardiomiopatia alcolica, danno cerebrale, miopatia, neuropatia etc.). La patogenesi di una così vasta gamma di alterazioni deve essere ricondotta principalmente ai meccanismi coinvolti nel metabolismo di tale sostanza che sono pertanto da sempre oggetto di studio anche se ciò che è stato maggiormente approfondito è la relazione tra alcol e fegato. Diversi studi si sono focalizzati anche sugli effetti dell’alcol sul tubo digerente, portando in questo modo al concetto dell’esistenza di un doppio meccanismo di danno epatico: uno diretto e l’altro mediato dall’intestino. Per quanto riguarda questo secondo meccanismo, studi recenti hanno evidenziato come sia proprio la flora batterica intestinale a giocare un ruolo molto importante nella genesi e nella progressione della patologia epatica, così come anche di altre 7 patologie alcol correlate. In primo luogo, nel tempo si è fatto strada sempre più il concetto di un metabolismo “batteriocolonico”, attraverso il quale vi sarebbe una produzione di alte concentrazioni di acetaldeide da parte dei batteri che porterebbe tanto ad un danno alla mucosa del colon, quanto, attraverso il sangue portale, ad un insulto epatico; i batteri intestinali rappresenterebbero quindi un importante organo deputato al metabolismo dell’alcol (6-8). Tuttavia, le relazioni tra alcol-intestino-fegato non si esauriscono soltanto nella produzione di un metabolita tossico, ma sembrano essere più complesse. Infatti, sono le endotossine che provengono dai batteri intestinali che giocano il ruolo più importante nell’iniziazione e progressione del danno epatico, una connessione che era stata già sospettata da diversi anni a questa parte per il riscontro di elevati livelli di endotossinemia in pazienti con malattia epatica alcol correlata (9, 10); tale relazione è stata poi confermata anche in studi successivi. Tre meccanismi diversi, ma necessariamente concomitanti, potrebbero essere responsabili di tale condizione: 1) sovra-crescita batterica 2) alterata permeabilità intestinale 3) ridotta capacità di clearance da parte delle cellule di Kupffer Per quanto riguarda il primo punto, in letteratura esistono pochi studi che suggeriscono una correlazione tra il consumo di alcol e la crescita 8 batterica; in quello di Bode et al. del 1984, (11) uno dei primi, veniva analizzata la microflora a livello digiunale di pazienti alcolisti rispetto ad un gruppo di controllo con il risultato di una differenza sia quantitativa che qualitativa imputabile a fattori quali alterazioni della motilità gastrica ed intestinale e della secrezione acida gastrica. Negli anni successivi vi sono state altre evidenze a supporto di tale risultato, rimanendo tuttavia non chiariti alcuni aspetti, ad esempio quali tipi di batteri sono alterati nel consumo alcolico, o se tali alterazioni si verificano con un meccanismo dose dipendente (12-13). Maggiormente studiati i meccanismi di alterata permeabilità intestinale sia in modelli animali che nell’uomo, utilizzando varie molecole come l’emoglobina (14), il PEG o polietilene glicol (15), etc. Un’alterata permeabilità intestinale veniva dimostrata inoltre in seguito all’infusione intra-gastrica di etanolo e LPS, ma non con la sola somministrazione di LPS, a dimostrazione della capacità dell’etanolo nel determinare alterazione della permeabilità intestinale a diverse molecole comprese le endotossine (16). In aggiunta, anche alte concentrazioni di acetaldeide prodotte a livello intestinale, sono responsabili di un incremento della permeabilità (17). Tutti i meccanismi sono riassunti nella fig.1. 9 Alcol CRESCITA BATTERICA NO e anione superossido Acetaldeide intestinale Endotossine intestinali Ridistribuzione delle proteine dalle giunzioni intercellulari al comparto intracellulare con meccanismo fosforilazione dipendente Permeabilità intestinale endotossinemia Vena porta Cellule di Kupffer Vasi linfatici edematici Danno d’organo TNF-α, IL-1, ROS Danno epatico Fig.1. Relazione tra alcol-intestino e fegato: con meccanismo in parte diretto, in parte mediato dall’acetaldeide, l’alcol determina sovracrescita batterica e un’aumentata permeabilità intestinale con conseguente endotossinemia e danno epatico. 10 Cirrosi epatica e asse intestino-fegato Il ruolo che riveste la flora intestinale nell’ambito della cirrosi epatica, sia per quanto riguarda la patogenesi, sia per quanto riguarda le possibili implicazioni terapeutiche, è complesso e non ancora completamente chiarito. In ogni caso la ricerca portata avanti in questo senso ha evidenziato un ruolo quasi centrale della flora batterica nella patogenesi delle complicanze dell’end stage della malattia epatica. Più precisamente si possono considerare due grandi ordini di complicanze nel corso della cirrosi epatica correlate alla flora batterica: quelle infettive, che vanno dalla batteriemia spontanea asintomatica alla sepsi; quelle emodinamiche rapportabili all’ipertensione portale e alla sindrome iperdinamica (HCS). Inoltre la flora intestinale, con la partecipazione di altri fattori, è implicata anche nell’insorgenza dell’encefalopatia epatica. Tali complicanze sono sottese da una condizione nota come traslocazione batterica la cui diretta conseguenza, associata ad un ridotta clearance epatica e alla presenza di shunts vascolari, è un aumento dei livelli di endotossine circolanti (LPS) principalmente nel sangue portale (18). L’LPS, una componente della parete dei batteri GRAM-, ha un ruolo chiave nel determinare un incremento di citochine pro-infiammatorie (TNF-α, IL-1, IL-6, IL-12) e di metaboliti dell’NO ed è stato dimostrato correlare non solo con i livelli di tali molecole, ma anche con la 11 severità della malattia epatica (19, 20); in questo modo si determina poi l’innesco di tutta una serie di eventi tra loro reciprocamente correlati e capaci di automantenersi, responsabili delle suddette complicanze. Traslocazione batterica ed endotossinemia La BT, termine coniato per la prima volta nel 1979, è definita come la migrazione di batteri o di prodotti batterici dal lume intestinale ai linfonodi mesenterici (MLNs) o ad altri siti extragastrointestinali (21, 22). Negli studi sperimentali animali si può parlare di traslocazione batterica in presenza di colture batteriologiche di MLN positive; nell’uomo tuttavia lo studio della BT è limitato, perché la dimostrazione di linfonodi mesenterici positivi richiede l’asportazione chirurgica con associata terapia antibiotica perioperatoria, che può determinare un’alterazione del risultato. Pertanto sono stati presi in considerazione approcci alternativi non invasivi di diagnosi di BT nell’uomo. Uno dei possibili marcatori di BT è rappresentato dal DNA batterico (bactDNA) evidenziato tramite PCR; l’identificazione nel sangue e nel liquido ascitico dei pazienti con cirrosi e colture negative di ascite è stato considerato come evidenza molecolare di BT (23). E’ stato inoltre dimostrato che il bactDNA determina, tramite l’attivazione dei macrofagi peritoneali, la produzione di citochine 12 (TNF-α, IL-6, IL-12 etc.) e di NO di derivazione iNOS (24). La validità di questo tipo di test, tuttavia, deve essere ancora largamente provata. Un ulteriore marcatore surrogato di BT è rappresentato dalla LBP (LPS binding protein), una proteina sintetizzata dal fegato in seguito al legame tra endotossine e complesso recettoriale CD14/TLR 4 (Toll like receptor 4); è stato dimostrato che i livelli di tale proteina aumentano nei pazienti con cirrosi e ascite (25). Nei cirrotici, i batteri che più frequentemente causano infezione e che hanno più tendenza a traslocare ai MLN, come già detto, sono batteri Gram- (specialmente E. coli, Klebsiella pneumoniae ed altre enterobacteriacee); anche se anche gli enterococchi e altri streptococchi possono traslocare (26). I meccanismi che sottendono la comparsa di BT in cirrosi sono essenzialmente quattro: a. Overgrowth batterico b. Disfunzione immunitaria c. Alterazione dei fattori luminali d. Alterata permeabilità intestinale (27) a) Meccanismo principale e necessario, anche se non sufficiente, alla base della BT, la sovra-crescita di batteri (IBO) si verifica frequentemente in corso di cirrosi e sembra essere correlata al grado di 13 disfunzione epatica (28). In particolare è stato dimostrato esserci un’alta prevalenza di sovra-crescita batterica nel piccolo intestino (SIBO) che si correla alla presenza di endotossinemia; il cut off utilizzato più largamente per il SIBO è la presenza globale di colonie ≥ 105 CFU per millilitro di secrezione digiunale (29) con una prevalenza in cirrosi che va dal 48% al 73% a seconda delle casistiche. Tale condizione sembra essere dovuta principalmente ad una ipodismotilità intestinale, i cui meccanismi di base sono ancora poco conosciuti. Pochi sono inoltre gli studi esistenti al riguardo; tra questi, i più rappresentativi sono quelli di Madrid et al. del 1997, dove si dimostra nel paziente epatopatico la presenza di un'alterazione della motilità intestinale, in particolare del piccolo intestino. Tale alterazione dipende dalla classe Child della malattia di qualsiasi eziologia e non è determinata da disfunzioni del sistema neuroendocrino che regola la motilità intestinale, in quanto tali alterazioni rientrano in seguito a trapianto. Non venivano chiariti però i meccanismi patogenetici di tale alterazione motoria (30, 31); in uno studio più recente è stata dimostrata un’anomala propagazione delle onde peristaltiche in pazienti con ipertensione portale non presente in pazienti controllo senza ipertensione portale; pertanto sembra che sia l’ipertensione portale la condizione significativamente correlata a tali anormalità (32). Inoltre la stessa sovra-crescita batterica è in grado di 14 alterare la motilità intestinale, come dimostrato da un miglioramento di essa mediante la decontaminazione intestinale con antibiotici, venendosi a creare in questo modo un circolo vizioso (33). b) Per quanto riguarda gli aspetti immunologici, in corso di cirrosi esiste una grande varietà di alterazioni sia di tipo sistemico (ipergammaglobulinemia policlonale, produzione di autoanticorpi, depressione dell’attività immunitaria di tipo cellulare e delle natural killer, ridotta attività del sistema reticolo endoteliale), sia di tipo locale, cioè a livello intestinale. Il RES è il principale meccanismo di difesa contro la batteriemia e le infezioni; le cellule di Kupffer rappresentano la principale componente del RES, tuttavia la sua attività in corso di cirrosi è ridotta sia per un’alterata funzione funzione fagocitica sia per la presenza di shunt che by-passano il fegato (34). In particolare le alterazioni delle difese immunologiche intestinali interessano principalmente la distribuzione e la funzione dei linfociti intraepiteliali (IELs), come dimostrato in studi sperimentali di cirrosi indotta nel ratto. Il sistema linfatico associato alla mucosa intestinale che è il più vasto organo linfatico dell’organismo ed è un organo indipendente, ha una funzione indispensabile nel mantenere l’equilibrio tra la flora batterica intestinale e l’ospite, impedendo in questo modo l’insorgenza di infezioni. In condizioni di salute infatti soltanto pochi batteri estranei traslocano ai linfonodi mesenterici, ma 15 in presenza di difese immunitarie intatte, tali batteri non sopravvivono. Nella cirrosi indotta sperimentalmente nei ratti con la somministrazione di CCl4, si rileva un marcato decremento di IFN-α da parte dei IELs, di cui tuttavia non si conosce l’esatto meccanismo. Tale decremento di IFN-α in corso di cirrosi può a sua volta determinare un danno all’attività fagocitica dei macrofagi e di altre cellule con attività fagocitaria e in questo modo permettere ai batteri di moltiplicarsi e di migrare verso siti extragastrointestinali (35). c) I fattori che agiscono a livello del lume intestinale sono diversi: acidi biliari, IgA secretorie, mucine, defensine, lisozima, fosfolipasi A2 etc. Tra questi quelli che hanno un ruolo molto importante sono gli acidi biliari, anche per una loro possibile applicazione terapeutica. Gli acidi biliari hanno un importante effetto trofico sulla mucosa intestinale, inibiscono la sovra-crescita batterica, soprattutto dei batteri anaerobi. Tali importanti funzioni sono dimostrate dall’evidenza di BT in corso di ittero ostruttivo, promossa dall’assenza di bile (36). In corso di cirrosi la secrezione di acidi biliari è diminuita, condizione che per i motivi su esposti, può contribuire alla crescita batterica e alla BT. A prova di ciò in uno studio viene dimostrato che la somministrazione di acidi biliari coniugati a ratti cirrotici con ascite determina una riduzione della crescita dei batteri a livello 16 dell’intestino, una riduzione della traslocazione batterica e dell’endotossinemia e quindi un aumento della sopravvivenza (37). d) Un’incrementata permeabilità intestinale di natura multifattoriale è stata associata alla cirrosi (38). I fattori responsabili della sua comparsa sono innanzitutto di tipo strutturale (congestione vascolare, edema della lamina propria, proliferazione fibromuscolare, ridotto rapporto villi/cripte, muscolaris mucosae ispessita etc); tali alterazioni sembrano essere correlate alla presenza di ipertensione portale, responsabile della comparsa di enteropatia ipertensiva (39). È coinvolta in aggiunta una condizione di alterato stato ossidoriduttivo, con un’incrementata attività della xantino-ossidasi e conseguente danno alla mucosa intestinale di tipo ossidativo ed incrementata perossidazione dei lipidi del brush border delle membrane (40, 41). Vi sono poi meccanismi funzionali che chiamano in causa l’NO; infatti la sua iperproduzione presente in corso di cirrosi ed ipertensione portale determina un alterazione dell’integrità della mucosa intestinale attraverso la dilatazione delle Tj, la distruzione dell’actina del citocheletro e l’inibizione della formazione di adenosina trifosfato che favoriscono l’aumento della permeabilità (42). La presenza di aumentata permeabilità intestinale è stata dimostrata sia nell’animale da esperimento (43, 44) sia nell’uomo; in vivo 17 tuttavia gli studi non sono molto numerosi e inoltre sono controversi suggerendo il dato che un’alterazione della permeabilità intestinale non ha un ruolo primario nella genesi della BT. Un’alterazione della flora batterica è stata evidenziata in soggetti alcolisti e in cirrotici, mediante test di assorbimento con diversi zuccheri (45-48). Da uno studio del nostro gruppo emerge il dato in accordo anche con la letteratura, che l’età, l’ipertensione portale, e l’uso di alcol sono fattori strettamente correlati all’alterazione di permeabilità intestinale. In tale studio emerge anche che la presenza di diabete incide sulla permeabilità, suggerendo l’ipotesi che l’iperglicemia può favorire il deficit di barriera intestinale. Inoltre il dato riscontrato di alterata permeabilità intestinale in pazienti senza cirrosi istologicamente documentata, suggerisce la possibilità di un suo ruolo di causa piuttosto che di effetto di malattia cronica epatica (49). Non è ancora chiaro, nella pratica clinica, quale tipo di paziente con malattia cronica di fegato deve essere sottoposto a un test di valutazione della permeabilità o quando tale test deve essere praticato; inoltre rimane anche da chiarire se lo studio della permeabilità possa avere un impatto nel management di un paziente con cirrosi; in ogni caso l’evidenza di un maggiore incremento dei livelli plasmatici di citochine proinfiammatorie e di nitrosotioli (espressione di aumentata 18 produzione di NO) in pazienti con alterata permeabilità intestinale rispetto ai pazienti con normale permeabilità rappresenta un’importante evidenza del coinvolgimento dell’alterazione della barriera intestinale nella genesi della BT e della flora batterica nell’ambito della malattia epatica e di conseguenza suggerisce l’importanza della sua manipolazione per il miglioramento del danno epatico. Ipertensione portale e sindrome iperdinamica L’ipertensione portale è una condizione caratterizzata da un rialzo patologico del gradiente pressorio tra vena porta e vana cava inferiore misurato come HVPG. Data la relazione tra flusso, pressione e resistenze, se tale condizione inizia per un aumento delle resistenze sinusoidali e post-sinusoidali, tuttavia essa si mantiene e viene aggravata dalla presenza di un aumento del flusso portale. Quest’ultima condizione deriva dalla presenza di una vasodilatazione del letto vascolare arterioso splancnico dovuto alla liberazione in circolo di mediatori vasodilatatori per effetto dello stress di parete esercitato dagli aumentati valori pressori. Tale condizione circolatoria splancnica è l’evento centrale di quella conosciuta come sindrome iperdinamica, responsabile delle maggiori complicanze della cirrosi (fig.2) (50). 19 HCS DISTRETTO SPLANCNICO DISTRETTO RENALE DISTRETTO POLMONARE SINDROME EPATORENALE ASCITE CRESCITA E SANGUINAMENTO VARICI DISTRETTO CARDIACO DISTRETTO CEREBRALE CARDIOMIOPATIA SINDROME EPATOPOLMONARE ENCEFALOPATIA EPATICA Fig.2. Complicanze sistemiche della sindrome iperdinamica del cirrotico. Il principale mediatore di tale condizione è rappresentato dall’NO, anche se altri mediatori sono variamente coinvolti in maniera diversa nei vari distretti dell’organismo (prostaciclina, adrenomedullina, glucagone etc.) (51). La sintesi di NO può essere indotta dall’attivazione di almeno tre sintetasi: iNOS, eNOS, nNOS; l’eNOS sembra essere la principale fonte di NO in corso di ipertensione portale; tuttavia esiste un’ulteriore produzione di NO indotta dall’endotossinemia come ipotizzato per la prima volta nel 1995 da Vallance e Moncada; secondo questa ipotesi esiste una produzione di citochine infiammatorie e di NO di derivazione iNOS a livello vascolare indotta 20 dalle endotossine di origine intestinale (52). Tale ipotesi è stata successivamente confermata in altri studi (52-55). Il risultato di questa serie di eventi è l’ulteriore sviluppo e mantenimento dell’HCS (fig.3). Nonostante l’endotossinemia e le citochine come TNFα rappresentino un importante stimolo per iNOS, uno studio del 1999 dimostra che in realtà l’NO prodotto per effetto dell’endotossinemia sia di derivazione eNOS, attraverso la stimolazione di GPT-cicloidrolasi e la sintesi di tetraidrobiopterina (56, 57). 21 CIRROSI IPERTENSIONE TRASLOCAZIONE BATTERICA Stiramento endoteliale, shear-stress endotossinemia eNOS eNOS ? iNOS? NO Vasodilatazione arteriosa splancnica Underfilling e ipovolemia relativa Attivazione dei sistemi neurormonali (SRAA-SNS) Ritenzione idro-salina e aumento del volume plasmatico Sindrome iperdinamica (basse resistenze vascolari e aumento dell’output cardiaco) Fig.3. Ruolo della flora batterica nell’insorgenza e nel mantenimento della sindrome iperdinamica. 22 In ogni caso, sia che la produzione di NO sia iNOS derivata, sia eNOS derivata, essa, correlata all’endotossinemia e alla BT, aggrava la vasodilatazione arteriosa della cirrosi. In tal modo si viene a creare un circolo vizioso che riconosce come primum movens l’ipertensione portale che porta all’aggravamento della funzione epatica (fig.4). CIRROSI IPERTENSIONE PORTALE ALTERATA PERMEABILITA’ INTESTINALE DISFUNZIONE HCS IBO ENDOTOSSINEMIA/BT ↑NO ↓FUNZIONE EPATICA INFEZIONI Fig.4. Il circolo vizioso dell’ipertensione portale e della sindrome iperdinamica con la partecipazione della flora batterica: tramite la produzione di NO vengono mantenute le alterazioni emodinamiche e tramite l’insorgenza di infezioni, viene aggravata la funzione epatica con ulteriore peggioramento dell’ipertensione portale. 23 In base a questo, nasce la necessità di interrompere tale circolo vizioso, impedendo la comparsa dell’endotossinemia di origine intestinale mediante agenti capaci di ridurre la traslocazione batterica e la conseguente endotossinemia rappresentati dagli antibiotici o dai probiotici. Flora intestinale ed infezioni Le infezioni batteriche si verificano in corso di cirrosi con un’incidenza che varia tra il 15% e il 47% ; di queste circa il 70-80% sono determinate da bacilli Gram- (E. coli, Klebsiella pneumoniae, altre Enterobacteriaceae, Pseuodomonas aeruginosa etc.) Tuttavia l’incidenza di infezioni sostenute da cocchi Gram+ si è negli ultimi anni accresciuta, essendo questo tipo di specie batteriche il più frequentemente isolato in soggetti cirrotici ospedalizzati con infezioni nosocomiali, particolarmente quelli ricoverati in unità di terapia intensiva, sede in cui sono più frequenti procedure invasive e largo uso di terapie antibiotiche croniche. I cirrotici che sviluppano un’infezione hanno una mortalità più alta rispetto ai pazienti cirrotici in assenza di infezione; i due fattori predittivi di sviluppo di infezioni sono rappresenti dalla severità della malattia epatica e dalle emorragie gastrointestinali; in quest’ultimo caso vi è un’incidenza di infezione del 45%, significativamente più alto rispetto al 32-34% dei cirrotici 24 ospedalizzati in generale (58-60). Anche i livelli sierici di albumina sono stati relazionati al rischio infettivo (61). In più, in numerosi studi è stata dimostrata una forte associazione tra infezione batterica e sanguinamento da varici esofagee, sia per il controllo del sanguinamento che per il rischio di risanguinamento (62). La traslocazione batterica e la ridotta attività battericida del RES, come già detto in precedenza, rappresentano i principali meccanismi responsabili dell’alto rischio infettivo in corso di cirrosi. Le principali infezioni che si presentano in corso di cirrosi sono la PBS, le infezioni del tratto urinario, la polmonite, l’empiema pleurico spontaneo e le batteriemie cosiddette spontanee. Esse sono definite così perché non vi è un evidente fonte di batteri che può spiegare la loro presenza nel sangue, nel liquido ascitico, pleurico etc. anche se ci sono evidenti prove che l’origine di tali infezioni è rappresentata proprio dall’intestino (63). Tra le infezioni la più caratteristica e quella a più alto rischio nel cirrotico è rappresentata dalla PBS. I pazienti con PBS hanno una più alta prevalenza di SIBO rispetto ai pazienti che non la presentano, così come, viceversa, i soggetti con SIBO hanno una più alta incidenza di PBS, rispetto a quelli che non hanno una grande sovra-crescita. Tali evidenze sono una prova del ruolo dei batteri intestinali nell’insorgenza di questa importante complicanza (64, 65). 25 Oltre alle infezioni su menzionate, la cirrosi rappresenta un fattore di rischio indipendente per sepsi (66, 67); a partire da un’infezione batterica, infatti si può giungere, tramite la iperproduzione di citochine e altri metaboliti, all’innesco e alla propagazione di una risposta infiammatoria sistemica associata poi ad alterazioni vascolari e della cascata coagulativa, condizione nota come SIRS (68). Come nella patogenesi dell’HCS, anche nella SIRS l’NO rappresenta il mediatore chiave della risposta infiammatoria; tuttavia, a differenza di quello che accade in assenza di cirrosi, le alterazioni vascolari della SIRS si sommano a quelle già presenti, giungendo in questo modo ad una condizione di ipotensione refrattaria, seguita da insufficienza renale, aggravamento della coagulopatia e dell’encefalopatia (69). Ciò porta ad una alta mortalità nei cirrotici con sepsi e shock settico rispetto a soggetti con shock settico non cirrotici (fig.5). 26 CIRROSI TRASLOCAZIONE BATTERICA HCS INFEZIONI BATTERICHE VASODILATAZIONE SIRS, SEPSI, SHOCK SETTICO DISFUNZIONE EPATICA IPOTENSIONE REFRATTARIA COAGULOPATIA ENCEFALOPATIA INSUFFICIENZA RENALE MORTE Fig.5. La cirrosi è un fattore di rischio importante per SIRS, sepsi e shock settico. Probiotici e cirrosi Il coinvolgimento della flora batterica nella patogenesi delle complicanze della cirrosi ha posto le basi per una possibile strategia terapeutica finalizzata alla modificazione dei batteri intestinali, sia da un punto di vista quantitativo sia qualitativo, con il risultato finale di contenere e ridurre il fenomeno di traslocazione batterica (70). 27 L’uso di microrganismi vitali, quali sono i probiotici, sembrano adattarsi a tale scopo grazie alle seguenti funzioni: • preservare l’equilibrio biologico naturale del tratto intestinale e modulare la crescita di altri gruppi di batteri • stabilizzare la barriera mucosa intestinale (71) • stimolare la resistenza dell’ospite all’infezione (72, 73). Le specie batteriche che maggiormente vengono impiegate sono rappresentate da Lactobacilli e Bifidobacteria, entrambe di tipo anaerobico; infatti, mentre i batteri aerobi Gram- traslocano facilmente anche attraverso un epitelio integro, i batteri anaerobi, che superano nell’intestino gli aerobi con un rapporto che va da 100 a 1 a 1000 a 1, traslocano molto più difficilmente e solo quando si verifica un danno all’epitelio intestinale. Ciò che è più importante è che i batteri anaerobi limitano la colonizzazione e la sovra-crescita dei batteri potenzialmente invasivi (74, 75). La somministrazione dei probiotici è stata già studiata in modelli animali di infezione addominale in assenza di cirrosi dove è stata dimostrata la capacità dei Lattobacilli di ridurre endotossinemia e batteriemie (76); in uno studio che ha impiegato il Lactobacillus R2LC è stata provata non solo la capacità di controllare la proliferazione di patogeni indesiderati, ma anche la capacità di determinare un’alterazione qualitativa delle specie batteriche attraverso la 28 produzione di acido lattico, acido acetico e perossido d’idrogeno con attività antibatterica e conseguente riduzione dei batteri potenzialmente patogeni. Inoltre sembra esserci una stimolazione dell’attività motoria intestinale con l’effetto di ridurre la sovra-crescita batterica (77). Nell’ambito della patologia epatica, sono stati condotti studi prevalentemente nell’animale da esperimento sia con modelli di danno acuto sia con modelli di ipertensione portale e cirrosi con risultati, tuttavia, non sempre univoci. Nell’ambito del danno acuto, tra i primi autori che hanno valutato l’efficacia dei microrganismi probiotici c’è stato Nanj nel 1994 con l’uso Lactobacillus GG. Nel suo studio si verificava un significativo miglioramento del danno epatico indotto dall’alcol nel ratto, rispetto agli animali controllo non trattati (78). A seguire due studi di Kasravi et al del 1996 e 1997 condotti nel ratto con danno epatico acuto indotto da D-galattosamina; nel primo, l’uso del Lactobacillus reuteri non sembrava comportare alcun beneficio sul danno epatico rispetto ai controlli; nel secondo, condotto con l’impiego di Lactobacillus plantarum, si verificava miglioramento del danno epatico (79, 80) . Altri studi sono stati condotti da Adawi et al.(1997, 1998, 2001, 2007) con varie combinazioni di Lattobacilli e Bifidobatteri con 29 dimostrazione di miglioramento del danno epatico e dei segni di BT (81-84). Gli studi praticati nei modelli animali di ipertensione portale e cirrosi sono stati effettuati usando prevalentemente varie specie di Lattobacilli. In un modello sperimentale di ipertensione portale pre-epatica, la batterioterapia con Lactobacillus non era in grado di determinare modifiche nella BT, verosimilmente per inefficacia nella modulazione della flora batterica; infatti la BT non era significativamente differente tra gli animali trattati con probiotico (82%) e quelli trattati con placebo (75%), sia usando Lactobacillus acidophilus sia Lactobacillus GG (85). Anche in un altro studio sperimentale di cirrosi indotta da CCl4 e ascite, volto a ricercare una strategia alternativa all’antibiotico-terapia nella profilassi per la PBS, la somministrazione di Lattobacilli si dimostrava inefficace nel prevenire la BT e le infezioni del liquido ascitico, nonostante l’ottima colonizzazione intestinale; tale studio metteva in evidenza l’importanza della severità della disfunzione della barriera intestinale in corso di ascite (86). Nello studio di Chiva et al. del 2002 venivano somministrati nei ratti con cirrosi indotta da CCl4 una combinazione di Lactobacillus johnsonii La1 e antiossidanti con il risultato di un decremento 30 dell’endotossinemia rispetto ai ratti controllo non trattati; inoltre si verificava una riduzione dei livelli di malonildialdeide (MDA) intestinale, indice di danno ossidativo della mucosa dell’intestino, a prova della partecipazione dello stress ossidativo nella patogenesi della BT; non veniva tuttavia valutata la reale efficacia del Lactobacillus johnsonii, non essendo stato somministrato in assenza di antiossidanti (87). Nell’ambito degli studi sull’uomo, è stata valutata l’efficacia dei probiotici in tre ambiti: la prevenzione delle infezioni, la funzionalità epatica e l’HCS. Per quanto riguarda la prevenzione delle infezioni, sono da riportare gli studi di Rayes N et al. del 2002 e del 2005 praticati in pazienti candidati a ricevere trapianto epatico; nel primo, venivano somministrati in un gruppo una combinazione di fibre e Lactobacillus plantarum 299, mentre in un altro gruppo veniva praticata la sola terapia antibiotica preoperatoria; i pazienti che avevano ricevuto terapia con probiotico e fibre avevano un tasso di infezioni postoperatorie più basso rispetto a quelli che avevano praticato decontaminazione intestinale con i soli antibiotici; nel secondo veniva utilizzata una miscela di probiotici e prebiotici (Synbiotic 2000) nel post-trapianto con il risultato di un basso tasso di infezioni (88, 89). 31 Nell’ambito della funzionalità epatica sono stati condotti due studi. Il primo è quello di Liu Q et al del 2004; anche se lo scopo dello studio era quello di valutare l’efficacia di simbiotici nell’encefalopatia minima (vedi dopo), si dimostrava, oltre al miglioramento di tale complicanza associato ad un decremento dell’ammoniemia, anche una riduzione dell’endotossinemia e della classe Child nel 50% circa dei casi (90). Nel secondo studio randomizzato controllato veniva somministrato come ceppo batterico a pazienti con cirrosi E. Coli Nissle; in tale gruppo di pazienti si verificavano, rispetto al gruppo controllo, una riduzione dell’endotossinemia e un miglioramento della funzione epatica valutata con lo score di Child-Pugh. Il meccanismo ritenuto responsabile era la restaurazione di una normale flora batterica a livello intestinale con conseguente minore assorbimento di metabolici tossici ed endotossine (91). Un solo studio è stato condotto sull’efficacia dei probiotici nel ridurre la pressione portale e il rischio di sanguinamento. In tale studio venivano praticati due cicli della durata di un mese di terapia con una combinazione di probiotici (Streptococcus thermophilus, Bifidobacteria, Lactobacillus acidophilus, L. plantarum, L.casei, L. delbrueckii bulgaricus, S. faecium) e veniva misurata la velocità del flusso ematico nella vena porta, splenica e mesenterica superiore, a 32 livello basale e al termine di ognuno dei cicli. Alla fine del secondo ciclo la velocità del flusso a livello della vena porta era aumentata rispetto ai valori basali, dimostrando in questo modo come, modificando la combinazione della flora batterica endogena, si determina un miglioramento delle alterazioni emodinamici della circolazione portale (92). 33 dei parametri 1. SCOPO DEL LAVORO Numerosi dati in letteratura indicano una stretta correlazione tra danno epatico e flora batterica intestinale, tuttavia non vi sono lavori recenti che, utilizzando metodiche più sensibili, documentino una variazione della flora batterica e della funzionalità della barriera intestinale in relazione al danno epatico. Inoltre dal momento che la fibrosi epatica è una condizione patologica oggi ritenuta reversibile, risulta di enorme interesse scientifico cercare dei rimedi che siano in grado di inibire o ritardare la progressione della fibrosi fino allo stadio di cirrosi. Gli scopi di questa ricerca sono stati: • riprodurre un modello sperimentale di fibrosi epatica nel ratto • studiare le variazioni della permeabilità e della microflora intestinale in rapporto al danno. • valutare l’effetto del trattamento con probiotici sul danno epatico attraverso il monitoraggio di parametri istologici, biochimici e molecolari associati alla fibrosi. 34 2. MATERIALI E METODI 2.1. Modello sperimentale di danno epatico Ratti Wistar maschi (peso di 220-250 g), dopo acclimatazione di una settimana dal loro arrivo, sono stati divisi in 3 gruppi di 10: 1. Ratti normali, 2. Ratti con fibrosi epatica, 3. Ratti con fibrosi epatica trattati con un simbiotico caratterizzato dalla presenza del ceppo B21060 di Lactobacillus paracasei (FLORTEC; Bracco SPA). Per indurre la fibrosi epatica ciascun ratto del gruppo (2) ha ricevuto un’iniezione sottocutanea di 0,50 ml di tetracloruro di carbonio (CCl4) diluito al 50% in olio di oliva. L’iniezione di tetracloruro di carbonio è stata effettuata due volte a settimana per una durata complessiva di 7 settimane. I ratti del gruppo (3) sono stati sottoposti allo stesso procedimento di induzione della fibrosi epatica e sono stati trattati con 1 ml di soluzione di probiotico (200 mg/kg al giorno) somministrato per via orale. Prima di procedere all’ induzione del danno epatico e al trattamento con probiotico, sono stati effettuati dei prelievi basali di sangue, feci e urine. 35 Al termine delle 7 settimane di trattamento sono stati nuovamente raccolti campioni di feci e urine; successivamente i ratti di ciascun gruppo sono stati sacrificati per raccogliere il sangue dall’arteria carotidea e prelevare il fegato. Sui vari campioni raccolti prima e dopo il trattamento sono stati valutati i seguenti parametri: • permeabilità intestinale • composizione della flora batterica intestinale • parametri biochimici di danno epatico • indici di flogosi su siero • espressione genica di TNF-α, IL-10, IL-1β, TLR2, TLR4, eNOS ed iNOS • determinazione dell’indice di fibrosi mediante analisi istologica 36 2.2. Valutazioni di Permeabilità Intestinale La permeabilità intestinale (IP) è un indice della funzione della barriera intestinale. Essa rappresenta il passaggio passivo attraverso l’epitelio intestinale, di acqua e piccole molecole inerti idrosolubili attraverso gli spazi intercellulari. La misura della IP si ottiene mediante la somministrazione orale di sonde molecolari (zuccheri) e dalla determinazione delle loro quantità escrete nelle urine in un arco di tempo minimo di 5 ore. Le sonde utilizzate devono essere idrosolubili, non tossiche, non assorbibili e in genere vengono somministrate in coppia. Le sonde hanno diversa grandezza; le più piccole con un diametro di 5-7 Å, in condizioni normali, attraversano l’epitelio intestinale nel dominio dei villi per il 15-20 % della quantità somministrata oralmente. Le più grandi, con un diametro di 10-12 Å, attraversano il dominio delle cripte intestinali in una quantità molto bassa (< del 2% della dose orale). La somministrazione in coppia delle sonde è utile per evitare interferenze dovute ad alterazioni sia del transito gastrointestinale (fattori pre-mucosali) che dell’escrezione urinaria (fattori post-mucosali). Nel test del doppio zucchero la permeabilità ai di- e mono-saccaridi non metabolizzabili è espressa come il rapporto dell’escrezione urinaria tra sonda grande e sonda piccola. Normalmente questo rapporto è di gran lunga inferiore a uno (93). Le sonde da noi impiegate nel test di permeabilità sono state 37 saccarosio, lattulosio e mannitolo. Il lattulosio è un disaccaride formato da due zuccheri semplici (fruttosio e galattosio; PM 342.3Da) e viene assorbito mediante passaggio paracellulare non mediato attraverso i pori collocati nell’area delle tight junction. Questo zucchero non viene idrolizzato dagli enzimi intestinali; tuttavia esso è un substrato per la fermentazione dei batteri del colon e pertanto può essere impiegato solo come marker della permeabilità del piccolo intestino. Il saccarosio (PM 342.3 Da) è un disaccaride, viene idrolizzato in glucosio e fruttosio dall’enzima saccarasi (presente sull’orlo a spazzola dell’intestino) per cui il suo assorbimento riflette la permeabilità gastrica. Il mannitolo è un monosaccaride (PM 182.17 Da) e viene assorbito attraverso i pori acquosi nelle membrane delle cellule epiteliali per cui il suo assorbimento riflette la permeabilità del piccolo intestino. Tale zucchero è assorbito mediante passaggio transcellulare non mediato e una riduzione nell’area di superficie della mucosa, associata all’atrofia dei villi, può ridurre il suo assorbimento. Prima e dopo le 7 settimane di trattamento con CCl4 i ratti di tutti e tre i gruppi sono stati sottoposti al test di permeabilità intestinale. Gli animali sono stati tenuti a digiuno per alcune ore dopodiché mediante un sondino hanno ricevuto 2ml di una soluzione contenente gli zuccheri sonda e sono stati trasferiti in gabbie metaboliche per raccogliere separatamente feci e urine. Ogni ratto ha ricevuto 1g di 38 saccarosio, 120 mg di lattulosio e 80 mg di mannitolo (94). La raccolta delle urine è stata effettuata per un totale di 24h dopodiché i ratti sono stati riposti nelle loro gabbie normali. Dopo aver misurato e registrato il volume delle urine, la loro composizione è stata analizzata mediante cromatografia liquida ad alta prestazione associata ad amperometria pulsata (HPAE-PAD). Per le analisi cromatografiche sono state preparate delle soluzioni standard degli analiti: l’appropriata quantità di ciascuno zucchero sonda è stata disciolta in acqua deionizzata e bidistillata in modo tale da ottenere per ciascuno di essi una concentrazione finale di 10 mM. Questa soluzione stock, aliquotata, è stata conservata a –20°C. Per ottenere la curva di calibrazione, al momento del saggio, la soluzione stock è stata diluita in modo da ottenere sei soluzioni standard a differenti concentrazioni ( 0,005 - 0,01 - 0,02 - 0,04-0,08 - 0,4 mM). Pertanto le concentrazioni urinarie degli zuccheri sonda sono state calcolate dalla curva di calibrazione mediante analisi dell’area sottostante i picchi. Le urine sono state filtrate attraverso un filtro da 0.22 µm e poi diluite. I campioni sono stati poi iniettati su una colonna a scambio anionico Dionex PA100 (volume di iniezione 25 µl ). La cromatografia a scambio anionico sfrutta la debole natura acida dei carboidrati per ottenere separazioni selettive ad elevati pH utilizzando una fase stazionaria forte a scambio anionico. Ad elevati pH i 39 carboidrati vengono ossidati elettrocataliticamente sulla superficie di un elettrodo d’oro mediante applicazione di un potenziale positivo. L’amperometria pulsata permette la detezione dei carboidrati in quantità anche al di sotto delle 10 pmol misurando la corrente elettrica generata dalla loro ossidazione sulla superficie di un elettrodo d’oro. Gli zuccheri sono stati eluiti utilizzando NaOH 160mM (eleuente A) ed NaOH 160mM + NaOAc 300mM (eluente B) con una velocità di flusso di 1ml/min (tempo = 0-6 minuti 100% eluente A; tempo = 13 minuti 53,2% di eluente A, 48,6% di eluente B); il flusso è di 1ml/min per tutta la durata del ciclo (93). I carboidrati presenti nell’eluente sono stati individuati mediante il modulo ED40 utilizzando un elettrodo d’oro e un triplo potenziale pulsato. L’elettrodo è stato mantenuto ai seguenti potenziali e intervalli di tempo: campionamento E1 = 0,05 V (t1 =0,40 s); ossidazione E2 = 0,75 V (t2 = 0,41 s); riduzione E3 = - 0,15 V (t3 = 0,61 s). 40 2.3. ANALISI DELLA MICROFLORA INTESTINALE MEDIANTE DGGE (Denaturing gradient gel electrophoresis). 2.3.1. Estrazione del DNA batterico Nella procedura di estrazione di 50 mg di feci sono stati trattati con 500 µl di tampone di lisi contenente lisozima (10 mg/ml) e proteinasi K. La sospensione è stata incubata a 37°C per 30 min. Dalle feci è stato estratto il DNA totale utilizzando il Maxwell® 16 System (Promega), un sistema automatizzato per l'estrazione di acidi nucleici. Lo strumento prevede l’utilizzo del kit fornito dalla stessa ditta il Maxwell® 16 DNA purification kit. Il DNA estratto, eluito in 400 µl di tampone di eluizione, è stato utilizzato previa quantizzazione, come target nelle reazioni successive di PCR. Le letture allo spettrofotometro (Ultrospec 2100 pro Spectrophotometer, Amersharm Biosciences Corporation, Piscataway, NJ) a λ 260 e il rapporto tra le letture a λ 260 e a λ 280 sono state impiegate per la quantizzazione del DNA ottenuto dall’estrazione e per determinare la sua purezza. 41 2.3.2. Amplificazione del DNA e sequenza nucleotidica degli ampliconi. Per mettere in evidenza la presenza di batteri nelle feci sono state effettuate reazioni di PCR che sfruttano l’uso di primer universali disegnati sulla sequenza nucleotidica del 16S rRNA. Due microlitri del DNA estratto sono stati utilizzati come templato e aggiunti ad una miscela di reazione composta da 10 µl di 5X Colorless Go Taq Flexi buffer (Promega, Madison, Wi, USA), 1.5 mmol/L MgCl2, 200 µmol/L di ciascun deossinucleotide trifosfato, 50 pmol di primer 5’- 3’ e 5’--3’ (95), e 1.25 U di GoTaq flexi DNA polymerase (Promega, Madison, Wi) per raggiungere un volume finale di 50 µl. I 35 cicli di reazione: 94°C per 30 secondi, 55°C per 30 secondi, e 72°C per 60 secondi sono stati effettuati in un termocycler GeneAmp 9700 (Applied Biosystems, Foster City, CA). I prodotti di amplificazione sono stati caricati su un gel di agarosio al 3% e quindi analizzati su gel DGGE (Denaturing gradient gel electrophoresis). 2.3.3. PCR-DGGE I primers utilizzati HDA1(5’-GAC TCC TAC GGG AGG CAG CAG T-3’) e HDA2 (5’-GTA TTA CCG CGG CTG CTG GCA-3’) sono descritti da Walter et al..2002. La reazione è stata condotta in un volume finale di 25µl contenenti Master Mix 1X, 0,5 µM di ciascun 42 primer e 1µl di DNA. Il ciclo di amplificazione ha previsto una denaturazione iniziale a 94°C per 4 min seguita da 35 cicli a 94°C per 1 min, 56°C per 1 min e 68°C per 1 min, estensione finale a 68°C per 7 min. Per la DGGE sono stati utilizzati due gradienti denaturanti: 40-60%, con gel di poliacrilammide al 8% (37,5:1 acrilamide/ bis acrilamide), TAE 1X, 7M di urea e 40% di formamide: Lo strumento utilizzato è l’IngenyphorU-2 system (Ingeny International, Goes, The Netherlands). Il gel aveva dimensioni di 28-cm per 18-cm e 1-mm di spessore. L’elettroforesi è stata condotta a 60°C per 18 ore a 80Volts. Dopo la corsa i gel sono stati colorati in SYBR Green 1X, TAE 1X e fotografati con raggi UV. 2.3.4. Sequenza degli ampliconi Le bande da identificare sono state ritagliate con un bisturi ed immerse in 100 µl di acqua. Il DNA così eluito è stato utilizzato in reazioni di PCR allo scopo di ottenere una quantità di DNA sufficiente per eseguire la sequenza nucleotidica. I prodotti di amplificazione ottenuti sono stati purificati con il kit commerciale Wizard Plus SV Minipreps- DNA Purification System (Promega, Madison, Wi). L’eluato ottenuto da questa procedura è stato poi quantizzato e sequenziato. Le sequenze nucleotidiche ottenute sono state analizzate 43 a scopo identificativo utilizzando i programmi NCBI BLAST (Basic Local Alignment Search Tool) e RDP (Ribosomal Database Project). 2.4. Valutazione di parametri biochimici di danno epatico. I campioni di sangue prelevati prima e dopo il trattamento sono stati centrifugati a 3000 rpm per 10’ a temperatura ambiente per poter separare il siero. Sui camponi di siero così ottenuti è stata effettuata la determinazione dei livelli di AST (alanina amminostransferasi), ALT (aspartato amminotransferasi), γ-GT (γ-glutammiltransferasi), ALP (fosfatasi alcalina) e bilirubina totale. 2.5. Determinazione di indice di flogosi su siero (TNF-α e IL-10) I prelievi di sangue dei ratti di ciascun gruppo eseguiti prima e dopo il trattamento, sono stati centrifugati ed il siero è stato congelato a -20°C fino all’uso. I livelli sierici di mouse/rat TNFα e di mouse/rat Il-10 sono stati determinati mediante test quantitativi ELISA basati su tecnica immunoenzimatica e secondo le indicazioni dei kit attualmente presenti in commercio (Quantikine ELISA-R&D Systems,USA). In questo test l’anticorpo policlonale specifico per le interleuchine è già fissato con legame covalente all’interno di pozzetti di una micropiastra. I campioni in esame, i controlli e gli standard sono stati aggiunti ai pozzetti in modo da potersi legare all’anticorpo. Dopo aver 44 effettuato diversi lavaggi con soluzione tampone, per eliminare sostanze non legate, è stato aggiunto un anticorpo secondario marcato con perossidasi. Dopo un periodo di incubazione e successivi lavaggi è stato aggiunto un substrato che, attraverso la produzione di una reazione enzimatica, sviluppa un composto colorato la cui intensità è direttamente proporzionale alla quantità di mouse/rat TNFα e di mouse/rat Il-10 presente nel campione in esame. La reazione è stata bloccata aggiungendo acido solforico 1N. Utilizzando uno spettrofotometro si è misurata la densità ottica a 450 nm e la concentrazione di TNF-α e IL-10 è stata calcolata mediante l’utilizzo di una curva standard (96, 97) . 2.6. Espressione genica di TNFα, IL-10, IL-1β, TLR2, TLR4, eNOS ed iNOS mediante RT-PCR 2.6.1. Estrazione dell'RNA dal tessuto epatico. L’estrazione dell’RNA dal tessuto epatico è stata effettuata seguendo il metodo della guanidina isotiocianato (metodi TRIZOL). Tutti i passaggi di estrazione sono stati eseguiti con materiali monouso e sterili, privi di contaminazione con RNasi e DNasi. Ogni campione di tessuto è stato omogeneizzato dopo aver aggiunto 1 ml di TRIZOL Reagent (Molecular Research Center,OH, US). 45 L’omogenato è stato raccolto e trasferito in un tubo Eppendorf da 1,5ml ed incubato a 4°C per 5 minuti per permettere la completa dissociazione dei complessi nucleoproteici. Dopo aver aggiunto 200 µl di cloroformio (Sigma), la miscela è stata agitata vigorosamente per 15 secondi e trasferita in ghiaccio per 10-15 minuti. Il campione è stato centrifugato a 7500 rpm (centrifuga Eppendorf mod. 5415R, rotore F45-24-11) per 20 minuti a 4°C. Dopo la centrifugazione la miscela si separa in una fase inferiore rossa (fase fenolo/cloroformio), un’interfase fioccosa e una fase acquosa superiore. L’RNA rimane esclusivamente nella fase acquosa, mentre DNA e proteine sono nell’interfase e nella fase inferiore. Il supernatante è stato recuperato delicatamente, vi è stato aggiunto 600µl di isopropanolo freddo (Fluka), è stato incubato a –20°C overnight ed infine centrifugato a 14000 rpm per 20 minuti a 4°C per far precipitare l’RNA. Il precipitato è stato lavato per due volte con etanolo freddo al 70%, poi seccato sotto lampada per evitare che permanessero tracce di alcool ed infine il campione è stato risospeso in 50 µl di H2O bidistillata trattata con dietilpirocarbonato (DEPC) (Sigma), che inattiva varie Rnasi. 46 La soluzione è stata sottoposta a digestione per 30 minuti a 37°C aggiungendo 1 µl di Dnasi I (2 unità/µl) (Ambion) e 0,1 volumi di tampone DNasi I 10x fornito dal Kit (DNA-freeTM, Ambion). Per eliminare la DNasi ed il DNA degradato sono stati eseguiti i seguenti passaggi: aggiunta di 0,1 volumi di reagente disattivante della Dnasi I (sempre fornito dal Kit) ed incubazione per 2 min a temperatura ambiente; la soluzione è stata quindi centrifugata a 10000 x g per 1 minuto al fine di precipitare il reagente inattivante; il supernatante, prelevato delicatamente, è stato posto in una nuova provetta. L’RNA è stato quantizzato spettrofotometricamente. Il campione è stato diluito 200 volte in H2O trattata con DEPC e ne è stata determinata la concentrazione in base al valore dell’assorbanza letta a 260 nm. La concentrazione viene determinata moltiplicando il valore di densità ottiche ottenuto per il fattore di diluizione. Si utilizza poi la relazione matematica 25 OD = 1 mg/ml di RNA (98). 2.6.2. RT-PCR semiquantitativa L’analisi dei livelli di mRNA dei geni TNFα, IL-10, IL-1β, TLR2, TLR4, eNOS ed iNOS è stata effettuata mediante RT-PCR, seguendo un protocollo opportunamente ottimizzato. La PCR è una tecnica che consente di amplificare selettivamente una piccola regione genomica delimitata da due sequenze specifiche. 47 Il frammento che si vuole amplificare è riconosciuto, ai suoi estremi, da due corti segmenti di DNA, i cosiddetti “primers” o “inneschi” (Tab. 3), oligonucleotidi di circa 20-mer complementari alle sequenze di basi che fiancheggiano il frammento. I primers avviano la polimerizzazione da parte della Taq-polimerasi; in ciascuno dei primi cicli di polimerizzazione, il numero di copie della sequenza bersaglio raddoppia, mentre in seguito la reazione perde il carattere di esponenzialità fino a raggiungere un plateau. Studi di cinetica della reazione hanno permesso di determinare che, nelle nostre condizioni, con 29 – 32 cicli la reazione di amplificazione (il numero varia in relazione ai tratti genici da amplificare) non raggiunge il plateau. Questo dato è di fondamentale importanza per garantire delle quantizzazioni attendibili; infatti, un’eventuale saturazione della reazione di amplificazione non permetterebbe di apprezzare le differenze quantitative fra i campioni. La tecnica di RT-PCR semiquantitativa, opportunamente ottimizzata, consente di ottenere indicazioni sui livelli di espressione di geni di interesse, misurando l’abbondanza degli mRNA trascritti da questi geni. Sono state determinate le variazioni del grado di espressione del gene, confrontando i livelli di mRNA specifico amplificato nelle cellule staminali stromali di midollo osseo con quelli dello stesso mRNA amplificato nelle cellule di controllo. 48 Nei nostri esperimenti, 200 ng di RNA sono stati retrotrascritti in cDNA in 25 µl di una soluzione contenente 32 ng/ml di una miscela di oligo-esameri a sequenza casuale (Pharmacia), 800 µM di una miscela di dNTP (Epicentre), 24 U di RNasina (Promega), tampone 1x per la trascrittasi inversa (Promega) e 1U di trascrittasi inversa AMV (Promega). 49 Tab.3 Primers utilizzati negli esperimenti di RT-PCR-semiquantitativa. GENE PRIMER SEQUENZA For 5’-AAATGGGCTCCCTCTCATCA-3’ Rev 5’-TCCTTAGGGCAAGGGCTCTT-3’ For 5’- TGGCTCAGCACTGCTATGTTG-3’ Rev 5’- TCCAGAGGGTCTTCAGCTTCTC-3’ For 5’- ACTTGGGCTGTCCAGATGAGA-3’ Rev 5’-GCCTGCAGTGCAGCTGTCTA-3’ For 5’-CGCATAGAGACATCCAAAGG-3’ Rev 5’-TTCTCACCCAGTCCTCATTC-3’ For 5’-CCCTTGACATCAGCAAGAAC-3’ Rev 5’-ACAGGAGTTCACAGGAGCAG-3’ For 5’- CTCAGGTTCTGTGTGTTTGG-3’ Rev 5’-GGATTTGCTGCTCTGTAGGT-3’ For 5’-AGCGAGTTGTGGATTGTTCT-3’ Rev 5’-CTTCGGGCTTCAGGTTATT-3’ For 5’-GTCATACCAGGAAATGAGCT-3’ Rev 5’-GCCAAAAGGGTCATCATCTC-3’ TNFα IL-10 IL-1β TLR4 TLR2 eNOS iNOS GAPDH L 50 L’RNA è stato preincubato con gli esameri e l’H2O per 10’ a 65°C, poi è stato raffreddato in ghiaccio per 5’ e, dopo l’aggiunta della trascrittasi inversa, del tampone e dei dNTP, incubato per un’ora a 42°C. In seguito 1-3 µl del prodotto della retro-trascrizione (la quantità dipende dal messaggio da amplificare) sono stati utilizzati per la successiva amplificazione; la miscela di reazione conteneva, in un volume finale di 25 µl, tampone 1x per la Taq polimerasi (Promega), 1,5 mM MgCl2 (Promega), 100 µM dNTP, 600 nM di ognuno dei due opportuni primers e 0,75 U dell’enzima Taq polimerasi (Promega). La reazione di amplificazione, effettuata con un apparecchio per PCR (Gene Amp 9700 Perkin Elmer), ha seguito il seguente protocollo: il primo passo della reazione di amplificazione prevede la denaturazione del DNA a 94°C per 3 minuti. Ad esso seguono 29 – 35 cicli che prevedono: - Denaturazione del DNA a 94°C per un minuto - Annealing tra DNA stampo e primers alla temperatura di annealing tipica della coppia di primers utilizzata per un minuto - Elongazione dell’amplicone a 72°C per un minuto. In ciascun esperimento di RT-PCR sono stati effettuati dei controlli negativi. I controlli negativi (che servono per dimostrare che il prodotto di amplificazione non provenga da contaminazione di DNA nell’RNA di partenza né sia il frutto di una contaminazione da parte 51 dell’operatore) sono stati effettuati sia sottoponendo a trascrizione inversa un campione contenente tutti i reagenti della reazione, ad eccezione dell’enzima della retro-trascrizione (controllo negativo della RT), sia amplificando un campione contenente tutti i reagenti della PCR tranne il cDNA (controllo negativo della PCR). I primers sono stati scelti mediante il software PRIMER 3 basandosi sulle sequenze di mRNA di GeneBank (DNASTAR Inc.,USA). Tutti i primers avevano una lunghezza di 20-22 nucleotidi e contenevano una percentuale in G-C compresa fra il 50 ed il 60%. Ogni campione è stato amplificato in triplicato, 12 µl di ogni amplificazione sono stati poi caricati su gel di agarosio al 2% e visualizzati mediante il “Gel Doc 1000 UV system” (BIO-RAD). I campioni di DNA da caricare sul gel sono stati appesantiti con una soluzione contenente 30% glicerolo, 0.25% Blu di bromofenolo. La dimensione dei prodotti di amplificazione è stata determinata mediante il confronto con il marcatore di peso molecolare Ladder 100 (M-Medical), che presenta bande di DNA di dimensione multipla di 100 paia di basi (cb). L’analisi densitometrica semiquantitativa è stata condotta utilizzando il software Quantity One (Bio-Rad). Per rendere i risultati indipendenti da eventuali errori nella quantizzazione e dal grado di purezza dell’RNA totale di partenza, in ogni esperimento l’amplificazione dei messaggi di interesse è stata accompagnata 52 dall’amplificazione dell’mRNA del gene GAPDH. Le variazioni dei livelli dell’mRNA sono state calcolate normalizzando i valori rispetto a questo controllo interno. La scelta è caduta su questo gene housekeeping, poiché si ritiene che il suo livello di espressione rimanga stabile nei processi da noi studiati. 2.7. Analisi istologica: colorazione rosso Sirio. Tale colorazione sfrutta la particolare affinità del Rosso Sirio verso le fibre collagene fornendo un utile parametro di valutazione del grado di fibrosi nelle biopsie epatiche (tab.4). La selettività di questo colorante nei confronti delle proteine collagene ci permette, inoltre, uno studio quantitativo computer-assistito. Tab.4. Colorazione Rosso Sirio. Fissazione: formalina al 10% Sezioni: 4 µm Soluzioni: A) Rosso Sirio F3B gr. 0.1 Ac.picrico Sol. Sat. ml 100 Procedimento: 1. Sparaffinare le sezioni e portarle in acqua distillata; 2. Incubare al buio, a temperatura ambiente, nella soluzione A per 15 min. 3. Effettuare una veloce disidratazione in tre cambi di alcool etilico assoluto. Diafanizzare in 3 cambi di xilolo. 4. Effettuare il montaggio dei vetrini. Risultato: Proteine collagene: Rosso 53 2.7.1. Analisi morfometrica Mediante l’uso del computer è possibile effettuare molteplici misure morfometriche su immagini digitali acquisite (image analysis). Tale principio è stato ampiamente sviluppato negli ultimi anni in vari settori della medicina ed in particolare nel settore istopatologico, fornendo utili elementi alla diagnosi terapeutica. Le workstation utilizzate in istopatologia prevedono l’uso di un computer collegato ad un microscopio provvisto di telecamera e ad altre periferiche, solitamente stampanti (fig.6). Fig.6. Workstation per IA Leica Quantimet Q500 IW. Le tappe fondamentali di un’analisi morfometrica condotta su un preparato istologico prevedono: 1. acquisizione e digitalizzazione delle immagini, ovvero la loro conversione in un'informazione numerica comprensibile al computer; 54 2. ottimizzazione delle immagini mediante soppressione del rumore, accentuazione del contrasto, rimozione di disomogeneità e strutture estranee che falserebbero il risultato di una misurazione automatica; segmentazione e classificazione delle immagini ottenute, intese come loro scomposizione in «oggetti» e «sfondo», calcolo dei parametri densitometrici, geometrici, classificazione e descrizione delle immagini. 2.7.2. Procedura di analisi per la fibrosi epatica I vetrini, opportunamente colorati con Rosso Sirio, vengono alloggiati sul piatto del microscopio Leica DM-LB con ottica planare N-Plan. Le sezioni subiscono un ingrandimento di 10x attraverso una video camera Sony 3CCD a colori ( modello DXC-950P ). Il livello di saturazione della luce deve essere regolato opportunamente per osservare nel modo migliore l’immagine ottenuta. Viene effettuata una scomposizione di immagine RGB, che utilizza i tre colori Rosso (Red), Verde (Green) e Blu (Blue). Le immagini sono state processate attraverso il sistema d' analisi d' immagine Leica Quantiment 500 IW e le operazioni a computer eseguite impiegando Windows, attraverso il software Leica QUIPS (Quantitative Interactive Programming System) (fig.7). Per ciascuna sezione sono stati esaminati 10 campi maggiormente rappresentativi attraverso acquisizione, digitalizzazione e processi d’ analisi. La misurazione è stata effettuata in automatico 55 dal sistema, che ha fornito la percentuale di fibre collagene in rapporto al tessuto stromale ed all’area totale. La procedura termina con la stampa del report e l’archiviazione dei dati (fig.8). a b c Fig.7. Analisi di immagine attraverso il software Leica QUIPS (Quantitative Interactive Programming System). 56 INIZIALIZZAZIONE: • Scelta ingrandimento • Livello di saturazione della luce • Impostazione dei valori soglia in RGB ANALISI • Rilevazione delle aree • Filtro morfometrico • Correzione artefatti Campo successivo MISURA Calcolo automatico: • % RS/area stromale • % RS/area totale Archiviazione dati Stampa report Fig.8. Schema riassuntivo della procedura di analisi di immagine per la valutazione dell’indice di fibrosi. 57 2. 8. Analisi statistica Tutti i risultati delle analisi ottenute sono stati espressi come media ± DS (deviazione standard) e per effettuare la comparazione tra le medie è stato utilizzato il “ t test di Student” per dati appaiati. Valori di p< 0.05 sono stati considerati statisticamente significativi. 58 3. RISULTATI 3.1. Permeabilità intestinale I dati ottenuti dimostrano che sia l’induzione di fibrosi con CCl4 che il trattamento con probiotico provocano un cambiamento delle percentuali di recupero sia del mannitolo (p<0,05) che del lattulosio (Fig.9). Mannitolo (% di recupero) Lattulosio (% di recupero) 1.6 5 0.07 * 1.1 0 0.03 ** * 0.00 Normali CCl4 CCl4+ pr 0.5 5 0.0 0 Normal i CCl CCl4 + pr Fig.9. Percentuali di recupero di mannitolo e lattuolosio nelle urine escrete nell’arco delle 24h. (* p<0.05 vs normali; **p<0.05 vs CCl4. 59 3.2. Analisi della microflora intestinale. La valutazione della microflora intestinale effettuata mediante DGGE, ha evidenziato nel colon dei ratti sani una flora batterica caratterizzata essenzialmente da: Clostridium (la cui specie non è risultata identificabile) ed una specie di Lactobaillus appartenente al gruppo Lactobacillus acidophilus e Lactobacillus intestinalis. Nei ratti in cui è stata indotta fibrosi con CCl4 è stato osservato un aumento di batteri appartenenti al genere Clostridium (presumibilmente specie papirosolvens) mentre in quasi tutti i ratti trattati con L. paracasei è stata osservata una diminuzione dei batteri appartenenti a questo genere (fig.10). 60 Fig.10. Analisi della composizione della microflora intestinale su gel DGGE. 61 3.3 Livelli sierici di AST e ALT I livelli sierici di AST, ALT, ALP e bilirubina totale risultano aumentati nei ratti con fibrosi epatica rispetto ai ratti controllo (p<0.05); tali valori risultano essere normalizzati dal trattamento con L. paracasei (Tab.5 ; Fig.11). Tab.5.Valutazione dei parametri biochimici su siero. Ratti trattati con CCl4 Controlli normali Ratti trattati con CCl4 + probiotico ALT 51,20 ± 9,3 114,4 ± 35,7* 40,6 ± 17,6 AST 72,50 ± 13,9 183,4 ± 61,5* 117,8 ± 21,7 ALP 56 ± 25,4 467,6 ± 273* 365,6 ± 68,4* γGT 4,2 ± 1,54 6,00 ± 1,60 4,4 ± 1,50 Bilirubina totale 0,24 ± 0,05 0,42 ± 0,08* 0,32 ± 0,08* (* p< 0.05 vs Normali). 150 250 AST * ALT * 20 100 15 10 50 5 0 0 normali CCl4 normali CCl4+ pr Fig.11. Livelli sierici di AST e ALT . 62 CCl4 CCl4+ pr 3.4. Livelli sierici di TNF-α e IL-10 I livelli di IL-10 sono risultati più bassi nel gruppo dei ratti con fibrosi rispetto al gruppo controllo e risultano significativamente aumentati dopo trattamento con probiotico (p<0.05; Tab.6; Fig.12) . I livelli di TNF-α sono aumentati durante la fibrogenesi epatica causata dal CCl4 rispetto ai valori misurati nei ratti del gruppo di controllo e sono risultati significativamente ridotti in seguito al trattamento con L. paracasei (p<0.05; Tab.6; Fig.12). Tab.6. Livelli sierici di mouse/rat TNF-α e di mouse/rat IL-10 determinati mediante test quantitativo ELISA. Controlli normali Ratti trattati con CCl4 Ratti trattati con CCl4 + probiotico IL-10 90±6,9 126,5±21,4 164,1±26,8* ** TNF-α α 47,4 ± 12, 3 44,1 ± 12,9 9,1 ± 13,8* ( * p< 0.05 vs Normali; **p<0.05 vs CCl4) TNF-α 100 * * ** IL-10 20 75 15 50 10 25 5 0 0 Normali CCl4 CCl4+ pr Normali CCl4 CCl4+ pr Fig.12. Livelli sierici di mouse/rat TNF-α e di mouse/rat IL-10 determinati mediante test quantitativi ELISA (* p< 0.05 vs Normali; **p<0.05 vs CCl4). 63 3.5. Espressione di mRNA di citochine anti-infiammatorie e proinfiammatorie su tessuto epatico di ratto Nei ratti sottoposti ad induzione con CCl4 si è riscontrato, rispetto ai ratti del gruppo di controllo, un aumento dei livelli dell’ mRNA per TNF-α, TGF-β1, TLR2 e TLR4; al contrario si è osservata una diminuzione dei livelli dell’mRNA per l’ IL-10. Nel gruppo di animali a cui è stato somministrato il probiotico si è invece evidenziata una diminuzione dei livelli degli mRNA per TNFα, TGF-β1, TLR2, TLR4 ed iNOS, rispetto ai ratti di controllo. I livelli dell’ mRNA per IL-10 ed eNOS risultano invece aumentati in tale gruppo di animali. I livelli di espressione del gene Il-1β non si sono modificati in seguito al trattamento con L.paracasei (fig.13 A e B). Fig.13.A. Effetto del trattamento con probiotico sulle citochine. 64 Fig.13.B. Effetto del trattamento con probiotico sui livelli di espressione dei Toll- like receptor e sulle isoforme della ossido nitrico sintasi. 3.6. Analisi istologica del tessuto epatico L’analisi istologica ha rivelato una normale architettura del tessuto epatico nei ratti del gruppo controllo. Nei ratti trattati per 7 settimane con CCl4 è presente una marcata fibrosi epatica con alterazione dell’architettura del tessuto, formazione di larghi setti fibrosi, separazione degli pseudolobi e accumulo di collagene (immagini rappresentative della morfologia del fegato sono mostrate nella fig.14). Queste alterazioni istopatologiche sia qualitative che quantitative risultano notevolmente ridotte nelle sezioni epatiche dei ratti che 65 hanno ricevuto quotidianamente il probiotico(fig.14.C). La riduzione della fibrosi è confermata anche dal dato quantitativo che mostra una ridotta percentuale di deposito di collagene nel fegato di ratti trattati con L. paracasei rispetto al gruppo di controllo (Tab.7). A B C Fig.14. (A) Fegato di ratto in cui è stata indotta fibrosi epatica con CCl4. (B) Colorazione Rosso Sirio su tessuto epatico di ratto con fibrosi indotta da CCl4. (C) ) Colorazione Rosso Sirio su tessuto epatico di ratto con fibrosi indotta da CCl4 + probiotico (Flortec). Tab.7. Determinazione della percentuale di fibre collagene sul fegato di ratti con fibrosi indotta da CCl4 e ratti con fibrosi indotta da CCl4 ma trattati con probiotico . *(p<0.05) vs Ratti CCl4. Ratti CCl4 %collagene 9.2 ± 2.9 66 RattiCCl4 + probiotico 2.4 ± 0.5a * 4. DISCUSSIONE La fibrosi epatica ed il suo stadio finale, la cirrosi, rappresentano il quadro comune finale di tutte le malattie croniche del fegato. Il danno epatico cronico che porta alla fibrosi avviene in risposta ad una varietà di insulti che includono: epatite virale (in particolare le epatiti da virus B e C), abuso di alcool, farmaci, disordini metabolici dovuti ad un sovraccarico di ferro o rame, attacco autoimmune agli epatociti o all’epitelio del dotto biliare, oppure anomalie congenite (99). La normale matrice extracellulare subendoteliale (ECM) è essenziale per il mantenimento delle differenti funzioni di tutte le cellule residenti nel fegato. Non appena il fegato diventa fibrotico, si verificano cambiamenti sia di tipo qualitativo che quantitativo nella composizione della ECM epatica. Il contenuto totale di collagene e di componenti non-collagene, aumentano di 3-5 volte, accompagnate da un cambiamento del tipo di ECM nello spazio subendoteliale per cui si passa da una normale matrice a bassa densità, simile ad una membrana basale, ad una matrice di tipo interstiziale contenente collagene formante fibrille (100). Le cellule stellate epatiche rappresentano il 15% del numero totale di cellule residenti nel fegato. Nel fegato normale esse sono il principale sito di accumulo dei retinoidi e costituiscono un gruppo eterogeneo di cellule che sono funzionalmente e anatomicamente molto simili ma 67 differiscono nella loro espressione di filamenti citoscheletrici, nel loro contenuto di retinoidi e nel loro potenziale per la produzione di ECM (101). In seguito a danno epatico di qualsiasi natura, le cellule stellate sono sottoposte ad una risposta nota come “attivazione”, ossia il passaggio da cellule quiescenti a miofibroblasti proliferativi, fibrogenici e contrattili. L’attivazione delle cellule stellate è una risposta notevolmente pleiotropica già altamente programmata. Gli stimoli che danno inizio all’attivazione delle cellule stellate derivano dagli epatociti danneggiati, dalle vicine cellule endoteliali e dalle cellule di Kupffer in aggiunta a rapidi e sottili cambiamenti nella composizione della ECM. Gli epatociti e le cellule di Kupffer sono una potente fonte di intermedi reattivi dell’ossigeno (ROI); tali composti esercitano una stimolazione paracrina delle cellule stellate (102). Per di più la loro attività è amplificata in vivo dalla deplezione di antiossidanti, come avviene normalmente nel fegato danneggiato. La sovra-espressione nelle cellule stellate del citocromo P4502E1, che genera i ROI, stimola l’espressione genica del collagene di tipo I e questo effetto viene attenuato dagli antiossidanti (103). Le cellule endoteliali giocano un duplice ruolo nell’attivazione precoce delle cellule stellate. Il danno alle cellule sinusoidali endoteliali stimola la produzione di una variante di splicing della fibronectina cellulare 68 (isoforma EIIIA), la quale ha un effetto attivante sulle cellule stellate (104). In aggiunta le cellule endoteliali convertono il fattore di crescita trasformante β1 (TGFβ1) nella forma attiva, fibrogenica, attraverso l’attivazione della plasmina. La perpetuazione dell’attivazione delle cellule stellate comprende delle risposte fenotipiche cruciali mediate da un incremento degli effetti delle citochine e dal rimodellamento della ECM (105). L’aumento della risposta delle citochine avviene attraverso meccanismi multipli (105), tra questi hanno una notevole importanza l’aumentata espressione dei recettori della membrana cellulare e un incremento del segnale (106). In modo particolare i recettori tirosinachinasi (RTKs), che mediano la maggior parte delle risposte delle cellule stellate alle citochine, sono largamente sovra-regolate durante il danno epatico (107). Durante questa fase la bassa densità della matrice sub-endoteliale è progressivamente sostituita da una ricca in collagene formante fibrille. Questo cambiamento fondamentale nella composizione della ECM influenza il comportamento degli epatociti, delle cellule sinusoidali endoteliali e accelera l’attivazione delle cellule stellate. Questi effetti sono mediati non solo attraverso le interazioni con le integrine, i classici recettori della ECM, ma anche attraverso il legame a RTK (100). Si possono identificare delle discrete reazioni fenotipiche delle cellule stellate man mano che la 69 loro attivazione viene perpetuata in risposta al danno epatico. Questi cambiamenti includono: (a) proliferazione; (b) contrattilità; (c) fibrogenesi; (d) degradazione della matrice; (e) chemotassi; (f) perdita di retinoidi; (g) rilascio di citochine e chemoattrazione delle cellule bianche del sangue. Nel danno acuto nell’uomo e nel danno epatico sperimentale il numero di cellule stellate attivate diminuisce non appena l’integrità del tessuto è ricostituita. Ciò pone una questione intrigante: cosa accade alle cellule stellate durante la risoluzione del danno? Esse ritornano a cellule quiescenti o vengono eliminate? (100) Una questione chiave non ancora risolta è se una cellula stellata attivata può ritornare allo stato quiescente. Uno degli stimoli che potrebbe controllare questa risposta è l’interleuchina-10 (IL-10). L’IL10 ha un effetto di down-regulation sull’infiammazione ed aumenta l’attività della collagenasi interstiziale (108,109); inoltre, essa viene indotta durante l’attivazione delle cellule stellate fornendo un segnale di feedback negativo autocrino per limitare l’accumulo di cicatrici. In aggiunta agli effetti delle citochine solubili, la regressione dell’attivazione delle cellule stellate potrebbe essere possibile mediante la ricostituzione della normale ECM subendoteliale. Un possibile destino delle cellule stellate attivate è l’apoptosi (110). L’apoptosi delle cellule stellate associata ad una ridotta espressione di 70 TIMP-1 è stata documentata durante la fase di recupero del danno epatico indotto sperimentalmente (111). Le cellule stellate vanno incontro ad apoptosi anche durante l’attivazione spontanea in parallelo ad un’aumentata espressione di CD95L (ligando del Fas), Bcl-2 e p53 (110). Sebbene siano noti i meccanismi patogenetici coinvolti nello sviluppo della fibrosi epatica, non si è riusciti ancora a stabilire una possibile terapia che possa prevenire la progressione di questa patologia o addirittura indurne la regressione. Alla luce delle strette relazioni esistenti tra intestino e fegato, abbiamo valutato il ruolo del microbiota nell’ambito dei processi patologici che portano alla formazione della fibrosi epatica, nonché il possibile effetto terapeutico della modulazione della flora batterica intestinale mediante somministrazione orale di probiotici. La somministrazione di Flortec (ceppo B21060 di L. paracasei) si è rivelata efficace nel trattamento della fibrosi epatica. Abbiamo osservato infatti non solo una riduzione della percentuale di fibre collagene prodotte nel tessuto epatico in seguito ad induzione del danno, ma anche una normalizzazione dei parametri biochimici valutati su siero. L’ induzione del danno epatico e l’effetto della somministrazione di probiotico, sono stati inoltre valutati analizzando i livelli di mRNA dei geni maggiormente implicati nel danno epatico. Le citochine 71 costituiscono un complesso network coinvolto nella regolazione delle risposte infiammatorie e nell’omeostasi delle funzioni di un organo e, nella fibrosi, un gran numero di citochine e di fattori di crescita potrebbe essere coinvolto nella modulazione del danno. I nostri esperimenti hanno evidenziato l’aumento dei livelli di mRNA del gene TNF-α rispetto ai ratti normali insieme ad una diminuzione dei livelli dell’mRNA per l’ IL-10, a dimostrazione del fatto che l’epatotossicità mediata dal CCl4 gioca un ruolo importante nella risposta infiammatoria. Inizialmente il CCl4 viene metabolizzato negli epatociti dal citocromo P450, dando origine a dei radicali triclorometilici altamente reattivi. Nel processo finale vengono attivate le cellule di Kupffer, le cellule stellate epatiche e le cellule endoteliali sinusoidali, per secernere le citochine che mediano la fibrogenesi epatica quali TGF-β1 (Transforming growth factor β1), associato all’attivazione delle HSC (Hepatic stellate cells) e alla conseguente produzione di ECM (extracellular matrix), e TNF-α considerato il principale mediatore di epatotossicità in diversi modelli sperimentali di danno epatico (112). Al contrario la diminuzione dei livelli di IL-10, che abbiamo riscontrato nei ratti indotti con CCl4, è in accordo con il ruolo di questa citochina che, riducendo l’effetto epatotossico, agisce come modulatore della risposta infiammatoria. 72 Dal momento che i Toll-like receptors (TLR) giocano un ruolo importante nella fisiopatologia del fegato, abbiamo valutato l’ espressione dei geni TLR2 e TLR4. Anche in questo caso il trattamento con L. paracasei ha portato ad una diminuzione dei livelli degli mRNA di questi due recettori e in modo particolare del TLR2. Secondo studi recenti l’espressione di TLR2 negli epatociti è upregolata dai lipopolisaccaridi (LPS), dal TNF-α, dalla lipoproteina batterica e dall’ IL1β in un modo NF-kB dipendente, indicando che gli epatociti diventano più responsivi ai ligandi di TLR2 in corso di infiammazione. Al contrario l’espressione di TLR4 negli epatociti sembra non essere up-regolata dai mediatori pro-infiammatori. TLR4 viene espresso su due mediatori chiave della fibrogenesi epatica: le cellule di Kupffer e le cellule stellate epatiche. Le cellule di Kupffer esprimono nel fegato livelli più elevati di TLR4 e sono considerate il principale target dell’ LPS, inoltre il TLR4 espresso sulle cellule stellate quiescenti e attivate, è il principale mediatore di fibrosi. L’attivazione di TLR4 induce una downregulation dello pseudorecettore di TGF-β (Bambi) sulle cellule stellate. Ciò promuove l’attivazione delle cellule stellate epatiche attraverso il TGF-β prodotto dalle cellule di Kupffer e, di conseguenza, la fibrosi (113). Il trattamento con L.paracasei riduce il livello di mRNA per TNF-α, TGF-β1, TLR2, TLR4 ed iNOS e aumenta i livelli di mRNA per IL-10 73 ed eNOS. Per quanto riguarda l’espressione delle due isoforme della ossido nitrico sintasi, le variazioni osservate sono in accordo con il dverso ruolo svolto da questi due enzimi nel danno epatico cronico. L’aumento di espressione di iNOS durante la fibrosi genera stress ossidativo ed uno stato pro-infiammatorio al contrario, la minore espressione di eNOS, influenza la microcircolazione epatica (114). Gli effetti benefici derivati dal trattamento con il probiotico possono essere correlati al fatto che la colonizzazione del tratto gastrointestinale, da parte di questo batterio, risulti in una modificazione della flora batterica a scapito di specie batteriche proinfiammatorie. La rimozione dell’insulto infiammatorio potrebbe essere uno dei potenziali meccanismi mediante i quali i batteri probiotici possono modulare la gravità di un danno. Inoltre il probiotico potrebbe avere una più diretta interazione con il sistema immunitario a livello della mucosa intestinale. Dati preliminari indicano una diminuzione della permeabilità intestinale nei ratti trattati con L.paracasei, come si evince dalla diminuzione dell’assorbimento di lattulosio e di mannitolo registrata in seguito al test di permeabilità. Tuttavia nei nostri esperimenti l’assorbimento delle sonde è risultato molto basso, in particolare per il mannitolo e per il saccarosio mentre il rapporto La/Ma è risultato invertito, a differenza di quanto riportato in letteratura oltre che 74 nell’uomo. Le analisi di composizione della microflora intestinale effettuate mediante DGGE hanno evidenziato, nei ratti in cui è stata indotta fibrosi con CCl4, un aumento di batteri appartenenti al genere Clostridium di cui non è stato possibile identificarne la specie. In quasi tutti i ratti trattati con L. paracasei è stata osservata una diminuzione dei batteri appartenenti a questo genere. Alla luce delle diverse problematiche riscontrate sono in corso ulteriori esperimenti per poter indagare ulteriormente sull’aspetto di permeabilità e sulla composizione della microflora intestinale. 75 5. CONCLUSIONI I nostri risultati hanno dimostrato che il ceppo B21060 di Lactobacillus paracasei migliora il danno epatico in quanto: • riduce la permeabilità intestinale al mannitolo • riduce i livelli sierici dei parametri biochimici • riduce la quantità di collagene presente nel tessuto epatico • riduce l’ espressione genica di TNF-α, iNOS, TLR2 e TLR4 • riduce i livelli di TNF-α nel siero • aumenta i livelli di IL-10 nel siero • aumenta i livelli di mRNA per eNOS ed IL-10 nel tessuto epatico. Questi dati indicano che tali batteri probiotici possono essere degli interessanti “agenti bio-terapeutici” per il trattamento della fibrosi epatica, agendo sulla composizione della flora batterica intestinale e sull’attività del sistema immunitario. 76 BIBLIOGRAFIA 1. Norman K, Pirlich M. Gastrointestinal tract in liver disease: which organ is sick? Curr Opin Clin Nutr Metab Care 2008; 11(5): 613-9. 2. Zeuzem S. Gut liver axis. Int J Colorectal Dis 2000; 15(2):5982.Bunnet NW, Walsh JH. Gastrointestinal hormones and neurotransmitters. In: Feldman M, Scharschmidt BF, Sleisenger MH (eds) 1998. Gastrointestinal and liver disease. Saunders, Philadelphia, 3-18. 3. Janowitz HD. Inflammatory bowel disease after 1932. Mt Sinai J Med 2000; 67(3):190-7. 4. Pereira SP, Rhodes JM, Campbell BJ, et al. Biliary lactoferrin concentration are increased in active inflammatory bowel disease: a factor in the pathogenesis of primary sclerosing cholangitis? Clin Sci (Colch) 1998; 95: 637-44. 5. Visapää JP, Tillonen J, Salaspuro M. Microbes and mucosa in the regulation of intracolonic acetaldehyde concentration during ethanol challenge. Alcohol Alcohol 2002; 37(4): 322-6. 6. Salaspuro M. Alcohol metabolism by gut flora. Metabolic, pathogenetic, and clinical implications. In Agarwal DP & Seitz HK (eds) 2001 Alcohol in Health and Disease, 67–85. 77 7. Salaspuro M. Bacteriocolonic pathway for ethanol oxidation: characteristics and implications. Ann Med 1996; 28: 195–200. 8. Bode C, Kugler V, and Bode, JC. Endotoxemia in patients with alcoholic and non-alcoholic cirrhosis and in subjects with no evidence of chronic liver disease following acute alcohol excess. J Hepatol 1987 ; 4: 8–14. 9. Fukui H, Brauner B, Bode JC, et al. Plasma endotoxin concentrations in patients with alcoholic and non-alcoholic liver disease: reevaluation with an improved chromogenic assay. J Hepatol 1991; 12: 162–9. 10.Bode JC, Bode C, Heidelbach R, et al. Jejunal microflora in patients with chronic alcohol abuse. Hepatogastroenterology 1984; 31: 30–4. 11.Hauge T, Persson J, Danielsson D. Mucosal bacterial growth in the upper gastrointestinal tract in alcoholics (heavy drinkers). Digestion 1997; 58: 591–5. 12.Bode C, Kolepke R, Scha¨fer K, et al. Breath hydrogen excretion in patients with alcoholic liver disease-evidence of small intestinal bacterial overgrowth. Z Gastroenterol 1993; 31:3–7. 13.Bungert HJ. Absorption of hemoglobin and hemoglobin iron in alcohol-induced liver injury. Digestion 1973; 9: 293–308. 78 14.Parlesak A, Scha¨fer C, Schu¨ tz T, Bode JC, et al. Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol induced liver disease. J Hepatol 2000; 32: 742–7. 15.Lambert JC, Zhou Z, Wang L, et al. Prevention of alterations in intestinal permeability is involved in zinc inhibition of acute ethanol-induced liver damage in mice. J Pharmacol Exp Ther 2003; 305: 880–6. 16.Ferrier L, Berard F, Debrauner L, et al. Impairment of intestinal barrier by ethanol involves enteric microflora and mast cell activation in rodents. Am J Pathol 2006; 168: 1148– 54. 17.Garcia-Tsao G, Wiest R. Gut microflora in the pathogenesis of the complications of cirrhosis. Best Pract Res Clin Gastroenterol 2004; 18: 353–72. 18.Lin RS, Lee FY, Lee SD, et al. Endotoxemia in patients with chronic liver diseases: relationship to severity of liver diseases, presences of esophageal varices, and hiperdynamic circulation. J Hepatol 1995; 22: 165-72. 19.Bigatello LM, Broitman SA, Fattori L, et al. Endotoxemia, encephalopathy, and mortality in cirrhotic patients Am J Gastroenterol 1987; 82(1): 11-5. 79 20.Wiest R, Rath HC. Gastrointestinal disorders of the critically ill. Bacterial translocation in the gut. Best Pract Res Clin Gastroenterol 2003; 17(3): 397-425. 21.Berg RD, Garlington AW. Translocation of certain indigenous bacteria from the gastrointestinal tract to the mesenteric lymphnodes and other organs in a gnotobiotic mouse model. Infect Immun 1979; 23: 403–11. 22.Such J, Frances R, Munoz C, et al. Detection and identification of bacterial DNA in patients with cirrhosis and culture-negative, nonneutrocytic ascites. Hepatology 2002; 36: 135–41. 23.Francés R, Munoz C, Zapater P, et al. Bacterial DNA activates cell mediated immune response and nitric oxide overproduction in peritoneal macrophages from patients with cirrhosis and ascites. Gut 2004; 53: 860–4. 24.Albillos A, de la Hera A, Gonzales M, et al. Increased lipopolysaccharide binding protein in cirrhotic patients with marked immune and hemodynamic derangement. Hepatology 2003; 37(1): 208-17. 25.Steffen EK, Berg RD, Deitch EA. Comparison of translocation rates of various indigenous bacteria from the gastrointestinal tract to the mesenteric lymph node. J Infect Dis 1988; 157: 1032-38. 80 26.Riordan SM, Williams R. The intestinal flora and bacterial infection in cirrhosis. J Hepatol 2006; 45(5): 744–7. 27.Yang CY, Chang CS, Chen GH. Small intestinal bacterial overgrowth in patient with liver cirrhosis, diagnosed with glucose H2 or CH4 breath tests. Scand J Gastroenterol 1998; 33: 867-71. 28.Bauer TM, Schwacha H, Steinbruckner B, et al. Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxaemia. Am J Gastroenterol 2002; 97: 2364–70. 29.Madrid AM, Cumsille F, Defilippi C. Altered small bowel motility in patients with liver cirrhosis depends on severity of liver disease. Dig Dis Sci 1997; 42: 738–42. 30.Madrid AM, Brahm J, Buckel E, et al. Orthotopic liver transplantation improves small bowel motility disorders in cirrhotic patients. Am J Gastroenterol 1997; 92: 1044–5. 31.Gunnarsdottir SA, Sadik R, Shev S, et al. Small Intestinal Motility Disturbances and Bacterial Overgrowth in Patients With Liver Cirrhosis and Portal Hypertension. Am J Gastroenterol 2003; 98(6): 1362-70. 32.Sadik R, Abrahamsson H, Bjornsson E, et al. Etiology of portal hypertension may influence gastrointestinal transit time. Scand J Gastroenterol 2003; 38: 1039–44. 81 33.Rimola A, Soto R, Bory F, et al. Reticuloendothelial system phagocytic activity in cirrhosis and its relation to bacterial infections and prognosis. J Hepatol 1984; 4(1): 53-8. 34.Inamura T, Miura S, Tsuzuki Y, et al. Alteration of intestinal intraepithelial lymphocytes and increased bacterial translocation in a murine model of cirrhosis. Immunol Lett 2003; 90(1): 3– 11. 35.Slocum MM, Sittig KM, Specian RD, et al. Absence of intestinal bile promotes bacterial translocation. Am Surgeon 1992; 58: 305-10. 36.Lorenzo-Zúñiga V, Bartolí R, Planas R, et al. Oral Bile Acids Reduce Bacterial Overgrowth, Bacterial Translocation, and Endotoxemia in Cirrhotic Rats. Hepatology 2003; 37(3): 551-7. 37.Wiest R, Garcia-Tsao G. Bacterial Translocation (BT) in Cirrhosis. Hepatology 2005; 41(3): 422-33. 38.Misra V, Misra SP, Dwivedi M, et al. Histomorphometric study of portal hypertensive enteropathy. Am J Clin Pathol 1997; 108: 652–7. 39.Ramachandran A, Prabhu R, Thomas S, et al. Intestinal mucosal alterations in experimental cirrhosis in the rat: role of oxygen free radicals. Hepatology 2002; 35: 622–9. 82 40.Chiva M, Guarner C, Peralta C, et al. Intestinal mucosal oxidative damage and bacterial translocation in cirrhotic rats. Eur J Gastroenterol Hepatol 2003; 15: 145–50. 41.Salzman AL, Menconi MJ, Unno N, et al. Nitric oxide dilates tight junctions and depletes ATP in cultured Caco-2BBe intestinal epithelial monolayers Am J Physiol 1995; 268: G361G73. 42.Perez-Paramo M, Munoz J, Albillos A et al. Effect of propranolol on the factors promoting bacterial translocation in cirrhotic rats with ascites. Hepatology 2000; 31: 43-8. 43.Zhang SC, Wang W, Ren WY, et al. Effects of cisapride on intestinal bacterial and endotoxin translocation in cirrhosis . World J Gastroenterol 2003; 9(3): 534-8. 44. Pascual S, Such J, Esteban A, et al. Intestinal permeability is increased in patients with advanced cirrhosis. Hepatogastroenterology 2003; 50: 1482–6. 45.Zuckerman MJ, Menzies IS, Ho H, et al. Assessment of intestinal permeability and absorption in cirrhotic patients with ascites using combined sugar probes. Dig Dis Sci 2004; 49: 621–6. 46.Rao RK, Seth A, Sheth P. Recent advances in alcoholic liver disease. I. Role of intestinal permeability and endotoxiemia in 83 alcoholic liver disease. Am J Physiol Gastrointest Liver Physiol 2004; 286:G881-4. 47.Kalaitzakis E, Johansson JE, Bjarnason I, et al. Intestinal permeability in cirrhotic patients with and without ascites. Scand J Gastroenterol 2006; 41: 326-30. 48.Cariello R, Federico A, Sapone A, et al. Intestinal permeability in patients with chronic liver diseases: its relationship with the aetiology and the entity of liver damage. (Lavoro in corso di valutazione su Dig Liv Dis). 49.Wakiri Y, Groszmann RJ. The hyperdynamic circulation of chronic liver diseases: from the patient to the molecule. Hepatology 2006; 43(2 Suppl 1):S121-31. 50.Wiest R, Groszmann RJ. The paradox of nitric oxide in cirrhosis and portal hypertension: too much, not enough. Hepatology 2002; 35(2): 478-91. 51.Vallance P, Moncada S. Hyperdynamic circulation in cirrhosis: a role for nitric oxide? Lancet 1991; 337(8744):776-8. 52.Battista S, Bar F, Mengozzi G, et al. Hyperdynamic circulation in patients with cirrhosis: direct measurement of nitric oxide levels in hepatic and portal veins. J Hepatol 1997; 26(1): 75-80. 84 53.Guarner C, Soriano G, Tomas A, et al. Increased serum nitrite and nitrate levels in patients with cirrhosis: relationship to endotoxemia. Hepatology 1993; 18(5): 1139-43. 54.Chu CJ, Lee FY, Wang SS, et al.Hyperdynamic circulation of cirrhotic rats with ascites: role of endotoxin, tumour necrosis factor-alpha and nitric oxide. Clin Sci (Lond) 1997; 93(3): 21925. 55.Wiest R, Das S, Cadelina G, et al. Bacterial translocation in cirrhotic rats stimulates eNOS-derived NO production and impairs mesenteric vascular contractility. J Clin Invest 1999; 104(9): 1223-33. 56.Wiest R, Cadelina G, Milstien S, et al. Bacterial translocation up-regulates GTP-cyclohydrolase I in mesenteric vasculature of cirrhotic rats. Hepatology 2003; 38(6): 1508-15. 57.Caly WR, Strass E. A prospective study of bacterial infections in patients with cirrhosis. J Hepatol 1993; 18: 353-8. 58.Borzio M, Salerno F, Piantoni L, et al. Bacterial infection in patients with advanced cirrhosis: a multicentre prospective study. Dig Liver Dis 2001; 33 (1): 41-8. 59.Fernandez J, Navasa M, Gomez J et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedure and norfloxacin prophilaxis. Hepatology 2002; 35: 140-8. 85 60.Deschenes M, Villeneuve JP. Risk factors for the development of bacterial infections in hospedalized patients with cirrhosis. Am J Gastroenterol 1999; 94: 2193-7. 61.Thalheimer U, Triantos CK, Samonakis DN, et al. Infection, coagulation and variceal bleeding in cirrhosis. Gut 2005; 54(4): 556-63. 62.Vivas S, Rodriguez M , Palacio MA. Presence of bacterial infection in bleeding cirrhotic patients is independently associated with early mortality and failure to control bleeding. Dig Dis Sci 2001; 46(12): 2752-7. 63.Tandon P, Garcia-Tsao G Bacterial Infections, Sepsis, and Multiorgan Failure in Cirrhosis. Semin Liver Dis 2008; 28(1): 26-42. 64.Morencos FC, de las Heras-Castano G, Martin-Ramos L, et al. Small bowel bacterial overgrowth in patients with alcoholic cirrhosis. Dig Dis Sci 1995; 40: 1252–6. 65.Bauer TM, Steinbruckner B, Brinkmann FE, et al. Small intestinal bacterial overgrowth in patients with cirrhosis: prevalence and relation with spontaneous bacterial peritonitis. Am J Gastroenterol 2001; 96: 2962–7. 66.Brun-Buisson C, Doyon F, Carlet J, et al. Incidence, risk factors, and outcome of severe sepsis and septic shock in adults. 86 A multicenter prospective study in intensive care units. French ICU Group for Severe Sepsis. JAMA 1995; 274(12): 968-74. 67.Alberti C, Brun-Buisson C, Goodman SV, et al. European Sepsis Group Influence of systemic inflammatory response syndrome and sepsis on outcome of critically ill infected patients. Am J Respir Crit Care Med. 2003 Jul 1;168(1):77-84. Epub 2003 Apr 17. 68.Wong F, Bernardi M, Balk R, et al. Sepsis in cirrhosis: report on the 7th meeting of the International Ascites Club. Gut 2005; 54(5): 718-25. 69.Lirussi F, Mastropasqua E, Orando S, et al. Probiotics for nonalcoholic fatty liver disease and/or steatohepatitis. Cochrane Database Syst Rev 2007; (1):CD005165 70.Szabo G, Romics L Jr, Frendl G. Liver in sepsis and systemic inflammatory response syndrome. Clin Liver Dis 2002; 6(4): 1045-66. 71.Sheth AA, Garcia-Tsao G. Probiotics and liver disease. J Clin Gastroenterol 2008;42(Suppl 2): S80-4. 72.Salminen S, Isolauri E, Salminen E. Clinical uses of probiotics for stabilizing the gut mucosal barrier: successful strains and future challenges. Antonie Van Leeuwenhoek 1996; 70(2-4): 347-58. 87 73.Perdigón G, de Macias ME, Alvarez S, et al. Systemic augmentation of the immune response in mice by feeding fermented milks with Lactobacillus casei and Lactobacillus acidophilus. Immunology 1988; 63(1): 17-23. 74.Link H, Rochat F, Saudan KY, et al. Immunomodulation of the gnotobiotic mouse through colonization with lactic acid bacteria. Adv Exp Med Biol 1995; 371A: 465-7. 75.Wells CL, Maddaus MA, Reynolds CM, et al. Role of anaerobic flora in the translocation of aerobic and facultatively anaerobic intestinal bacteria. Infect Immun 1987; 55: 2689-94. 76.Johansson ML, Molin G, Jeppsson B, et al. Administration of different Lactobacillus strain in fermented oatmeal soup: in vivo colonization of human intestinal mucosa and effect on the indigenous flora. Appl Environ Microbiol 1993; 59: 15-20. 77.Thorlacius H, Nobaek S, Wang XD, et al. Lactobacilli attenuate bacteremia and endotoxemia associated with severe intraabdominal infection. Surgery 2003; 134(3): 467-73. 78.Nanj AA, Hettry U, Sadrzadeh SMH. Lactobacillus feeding reduces endotoxaemia and severity of experimental alcoholic liver disease. Proc Soc Exp Biol Med 1994; 205: 243–7. 79.Kasravi FB, Adawi D, Hagerstrand I, et al. The effect of pretreatment with endotoxin and lactobacillus on bacterial 88 translocation in acute liver injury. Eur J Surg 1996; 162: 537– 44. 80.Kasravi FB, Adawi D, Molin G, et al. Effect of oral supplementation of lactobacilli on bacterial translocation in acute liver injury induced by D-galactosamine. J Hepatol 1997; 26: 417–24. 81.Adawi D, Kasravi FB, Molin G, et al. Effect of Lactobacillus supplementation with and without arginine on liver damage and bacterial translocation in an acute liver injury model in the rat. Hepatology 1997; 25: 642–7. 82.Adawi D, Ahrne S, Molin G. Effects of different probiotic strains of Lactobacillus and Bifidobacterium on bacterial translocation and liver injury in an acute liver injury model. Int J Food Microbiol 2001; 70: 213–20. 83.Adawi D, Molin G, Jeppsson B. Inhibition of nitric oxide production and the effects of arginine and Lactobacillus administration in an acute liver injury model. Ann Surg 1998; 228: 748–55. 84.Osman N, Adawi D, Ahrné S, et al. Endotoxin- and Dgalactosamine-induced liver injury improved by the administration of Lactobacillus, Bifidobacterium and blueberry. Dig Liver Dis. 2007; 39(9): 849-56. 89 85.Wiest R, Chen F, Cadelina G, et al. Effect of Lactobacillusfermented diets on bacterial translocation and intestinal flora in experimental prehepatic portal hypertension. Dig Dis Sci 2003; 48: 1136–41. 86.Bauer TM, Fernandez J, Navasa M et al. Failure of Lactobacillus spp. to prevent bacterial translocation in a rat model of experimental cirrhosis. J Hepatol 2002; 36: 501–6. 87.Chiva M, Soriano G, Rochat I, et al. Effect of Lactobacillus johnsonii La1 and antioxidants on intestinal flora and bacterial translocation in rats with experimental cirrhosis. J Hepatol 2002; 37: 456–62. 88.Rayes N, Seehofer D, Hansen S, et al. Early enteral supply of Lactobacillus and fiber versus selective bowel decontamination: a controlled trial in liver transplant recipients. Transplantation 2002; 74: 123–7. 89.Rayes N, Seehofer D, Theruvath T, et al. Supply of pre- and probiotics reduces bacterial infection rates after liver transplantation – a randomized, double-blind trial. Am J Transplant 2005; 5: 125–30. 90.Liu Q, Duan ZP, Ha da K, et al. Synbiotic modulation of gut flora: effect on minimal hepatic encephalopathy in patients with cirrhosis. Hepatology 2004; 39: 1441–9. 90 91.Lata J, Novotný I, Príbramská V, et al. The effect of probiotics on gut flora, level of endotoxin and Child-Pugh score in cirrhotic patients: results of a double-blind randomized study. Eur J Gastroenterol Hepatol 2007; 19(12): 1111-3. 92.De Santis A, Famularo G, De Simone C. Probiotics for the hemodynamic alterations of patients with liver cirrhosis. Am J Gastroenterol. 2000; 95(1): 323-4. 93.Generoso M, De Rosa M, De Rosa R, et al. Cellobiose and lactulose couplet with mannitol and determined using ionexchange chromatography with pulsed amperometric detection, are reliable probes for investigation of intestinal permeability. Journal of chromatography B, 783 (2003) 349-357. 94.Meddings J, Gibbons I, Discrimination of site-specific alterations in gastrointestinal permeability in the rat; Gastroenterology 1998; 114: 83-92. 95.Walter, J., G.W. Tannock, A. Tilsala-Timisjarvi, S. Rodtong , D.M. Loach, K. Munro and T. Alatossava, 2000. Detection and identification of gastrointestinal Lactobacillus species by using denaturing gradient gel electrophoresis and species-specific PCR primers. Appl. Environ. Microbiol. 66:297-303. 96. Doherty, D.G. et al. (1999) J. Immunol. 163:2314. 97. Powrie, F. et al. (1993) Eur. J. Immunol. , 23:3043. 91 98. Chomczynski P. Sacchi N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Anal. Biochem. 1987; 16:156-9. 99.Friedman, S. L. (1998) in Diseases of the Liver (Schiff, E., Sorrell, M., and Maddrey, W., eds) 8th Ed., pp. 371–386, Lippincott-Raven, Philadelphia. 100. Scott, L. Friedman (2000) in The Journal of Biological Chemistry, vol.275, No.41 Issue of January 28, pp.2247-2250. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. 101. Knittel, T., Kobold, D., Saile, B., Grundmann, A., Neubauer, K., Piscaglia, F., and Ramadori, G. (1999) Gastroenterology 117, 1205–1221. 102. Maher, J. J. (1999) Alcohol Clin. Exp. Res. 23, 917–921 103. Nieto, N., Friedman, S. L., Greenwel, P., and Cederbaum, A. (1999) Hepatology 30, 987–996. 104. Jarnagin, W. R., Rockey, D. C., Koteliansky, V. E., Wang, S. S., and Bissell, D. M. (1994) J. Cell Biol. 127, 2037–2048. 105. Friedman, S. L. (1999) Semin. Liver Dis. 19, 129–140. 106. Pinzani, M., Marra, F., and Carloni, V. (1998) Liver 18, 2-13. 107. Ankoma-Sey, V., Matli, M., Chang, K. B., Lalazar, A., 108. Wang, S. C., Tsukamoto, H., Rippe, R. A., Schrum, L., and 92 Ohata, M. (1998) J. Biol. Chem. 273, 302–308. 109. Thompson, K. C., Trowern, A., Fowell, A., Marathe, M., Haycock, C., Arthur, M. J. P., and Sheron, N. (1998) Hepatology 28, 1518–1524. 110. Gressner, A. M. (1998) Cell Tissue Res. 292, 447–452 111. Iredale, J. P., Benyon, R. C., Pickering, J., McCullen, M., 112. Li-Juan Zhang et al. Effects of cytokines on carbon tetrachloride-induced hepatic fibrogenesis in rats. World Journal Gastroenterol 2004; 10(1): 77-81. 113. Mencin A, Kluwe J, Schwabe R F. Toll-like receptors as targets in chronic liver diseases. Gut 2009; 58:704-720. 114. Tung-Ming Leung et al. Endothelial nitric oxide synthase is a critical factor in experimental liver fibrosis. Int. J. Path. (2008), 89, 241-250. 93



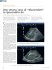


![Scarica l`articolo [pdf 194 kb] Scarica l`articolo [pdf 194 kb]](http://s1.doczz.it/store/data/000046743_1-c51d0ff13a0cbb592f0109f112cdfe02-70x70.png)