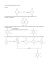saggi specifici acidi carbossilici
Transcript
saggi specifici acidi carbossilici
SAGGI SPECIFICI ACIDI CARBOSSILICI Acido Acetilsalicilico: - Per riscaldamento a secco con Ca(OH)2 sviluppa acetone i cui vapori, a contatto con una cartina imbevuta di o-nitrobenzaldeide, la colorano in verde-blu. - Per riscaldamento a secco si avverte evoluzione di CH3COOH. Per idrolisi alcalina fornisce acido salicilico. - Può fornire esito positivo in alcuni saggi dei fenoli (FeCl3, aurine) perché si idrolizza nelle condizioni di reazione. Acido Salicilico: - Decarbossila per riscaldamento a secco (odore fenolico); - Per trattamento con bromo produce 2,4,4,6-tetrabromo-2,5-cicloesadien-1-one (pf 92-93°C). RICERCA DEGLI ALCOOLI Alcol deidrogenasi (ADH) Aldeide deidrogenasi A - Saggio con Sodio Metallico Gli alcooli (primari, secondari o terziari) reagiscono con sodio metallico sviluppando idrogeno. Questo saggio però non è specifico per la sola funzione alcoolica in quanto reagiscono anche tutti quei composti che possiedono idrogeni attivi, a cominciare dall'acqua (altri es. acidi, fenoli, enoli). È opportuno operare in ambiente anidro, tenendo anche presente che l'umidità provoca in genere una reazione vivace ma di breve durata. Esecuzione Per l'esecuzione del saggio si introducono in una provetta ben asciutta 2-3 gocce del composto, previamente essiccato su MgSO4 o CaSO4 anidri (con i composti solidi si impiega una soluzione in benzene o in etere etilico anidro). Si introduce quindi nella provetta un frammento di sodio metallico tagliato di fresco e si copre con di cotone: la reazione positiva è indicata dallo sviluppo lento e continuo di bollicine gassose sulla superficie del sodio metallico (a differenza di quanto si verifica quando sono presenti tracce di umidità). B - Saggio con Acido Cromico Gli alcooli primari sono ossidati ad aldeidi che a loro volta vengono ossidate ad acidi carbossilici; gli alcoli secondari sono ossidati a chetoni. Gli alcoli terziari invece non reagiscono. Reattivo: si scioglie 1 g di CrO3 in 1 ml di H2SO4 concentrato e si diluisce lentamente con 3 ml di H2O. Esecuzione Per eseguire il saggio, si sciolgono 20 mg o 1 goccia dell'alcool in 1 ml di acetone puro (distillato su KMnO4) e si addiziona 1 goccia del reagente, agitando. Gli alcooli I° e II° reagiscono entro 10 secondi per dare una sospensione blu-verde opaca, mentre gli alcooli III° non reagiscono. Altre sostanze facilmente ossidabili come aldeidi, fenoli, enoli, ecc. danno reazione positiva. C - Formazione di Alchilxantogenati Gli alcooli primari e secondari, per trattamento con CS2 in presenza di un idrossido alcalino, forniscono i sali dei corrispondenti alchilxantogenati. Questi possono essere riconosciuti sia mediante la formazione di complessi colorati con molibdato ammonico (metodo A), sia attraverso la loro reazione di disproporzionamento in presenza di ioni rameici (metodo B). Esecuzione del saggio secondo il metodo A: Una soluzione di 1-2 gocce di sostanza in 4-5 gocce di CS2 vengono agitate per circa 5 minuti in una provetta, assieme a 1-2 pasticche di KOH macinate. Si aggiungono quindi 2-4 gocce di soluzione acquosa all'1% di molibdato di ammonio e, dopo dissoluzione del KOH, si acidifica leggermente con H2SO4 diluito. Dopo addizione di alcune gocce di CHCl3 si agita la miscela che, dopo pochi istanti di riposo, appare colorata in violetto nello strato cloroformico. Esecuzione del saggio secondo il metodo B 2-3 gocce del composto incognito e una pasticca di KOH vengono riscaldati in provetta su bagnomaria fino a dissoluzione del KOH. La miscela risultante è addizionata di 0,5-1 ml di CS2 e quindi trattata con alcune gocce di una soluzione molto diluita di CuSO4. Gli alcoli I° e II° forniscono un precipitato giallo. D - Reattivo di Lucas Questo saggio si basa sulla capacità di alcuni alcooli di reagire con il reattivo di Lucas per dare i corrispondenti cloro-derivati che, essendo molto meno solubili nel reattivo degli alcooli da cui derivano, appaiono come emulsioni o doppi strati; la reazione è applicabile ai soli alcooli solubili nel reattivo, che pertanto devono possedere una struttura semplice (generalmente costituita da non più di 5-6 atomi di carbonio). Reattivo: 136 g di ZnCl2 anidro sciolti in 105 g di HCl concentrato. Esecuzione del saggio Si aggiungono 3-4 gocce del composto a 2 ml del reattivo posto in una provetta: la soluzione risultante è agitata vigorosamente per qualche istante e quindi lasciata riposare a temperatura ambiente. Gli alcooli III°, aililici e benzilici e cinnamico forniscono rapidamente una opalescenza o un doppio strato dovuto all’alogenuro alchilico formatosi, mentre gli alcooli II° reagiscono più lentamente, ma comunque entro 2-5 minuti. Gli alcooli I° non reagiscono affatto. RICERCA DEI GRUPPI CARBONILICI ALDEIDI E CHETONI Saggio con Idrossilamina La reazione è comune alle aldeidi ed ai chetoni. Consiste nella formazione di ossime per reazione tra la funzione carbonilica e idrossilammina. Esecuzione: Il saggio consiste di aggiungere il reattivo alla sostanza in esame e di verificare il viraggio dell’indicatore. Saggio con 2,4-dinitrofenilidrazina Questo saggio è valido sia per aldeidi che per chetoni. Entrambi danno origine a formazione di precipitati colorati dal giallo al rosso (2,4-Dinitrofenilidrazoni). Il saggio può essere condotto anche in soluzione acquosa. R1 C O H2N H N NO2 R1 C N H N NO2 R2 R2 O2N H2O O2N Precipitato colorato Giallo Rosso-arancio per composti alifatici composti aromatici Esecuzione: In un tubicino da saggio si introducono 1 mL del reattivo e quindi una goccia o qualche granello del composto in esame. Si agita vigorosamente e se non si forma immediatamente un precipitato si lascia riposare la soluzione per 15 minuti. Il saggio è positivo nel caso si formi un precipitato colorato in giallo e rossoarancio. Interferisce l’acetaldeide presente in alcuni solventi. Preparazione del reattivo Si sciolgono 3 g di 2,4-dinitrofenilidrazina in 15 ml di H2SO4 conc. e la soluzione risultante viene aggiunta ad una miscela di 20 ml di acqua e 70 ml di etanolo al 95%. Si mescola bene ed infine si filtra. RICERCA DELLE ALDEIDI A- Reazione con il reattivo di Tollens B- Saggio con il reattivo di Fehling C- Saggio con il reattivo di Benedict D- Saggio con il reattivo di Molish E- Saggio con Acido Cromico G- Saggio con il reattivo di Shiff Saggio di Tollens Questo saggio, positivo per le aldeidi, non è dato dai chetoni, ad eccezione di quelli sostituiti sul carbonio in posizione α rispetto al carbonile con gruppi ossidrilici, alcossilici o dialchilamminici. Il saggio è positivo per gli zuccheri riducenti, amminofenoli, poliidrossifenoli, acido tartarico e idrossilamine. Reattivo: 1 ml di soluzione preparata sciogliendo 3 g di AgNO3 in 30 ml di H2O viene mescolato con 1 ml di soluzione di NaOH al 10% e quindi con una soluzione di ammoniaca molto diluita (2-3%) goccia a goccia, agitando vigorosamente, finchè l’idrossido di argento che era precipitato non risulta disciolto (evitare un eccesso di NH3). Per l’esecuzione del saggio si aggiungono poche gocce di una soluzione diluita del composto in esame a 2-3 ml del reattivo. La formazione di uno specchio argenteo sulle pareti del tubo o di un precipitato nero di argento finemente suddiviso, già a freddo o dopo lieve riscaldamento a bagnomaria (max. 40° C) indica saggio positivo. IDROSSIDO AMMONIACALE Saggio con reattivo di Fehling Il saggio risulta positivo con le aldeidi alifatiche, mentre è generalmente negativo con le aldeidi aromatiche ed i chetoni, ad eccezione degli αidrossichetoni (il saggio è positivo anche per gli zuccheri riducenti). Reattivo: Soluzione A: 7 g di solfato di rame pentaidrato in 100 ml di H2O; Soluzione B: 36,4 g di tartrato sodico potassico e 10 g di NaOH in 100 ml di acqua. Esecuzione del saggio Ad una miscela in parti uguali di soluzione A e B (circa 2 ml) si addiziona una goccia del composto liquido o una quantità equivalente del composto solido e si scalda su bagnomaria per alcuni minuti. La reazione è positiva se si ha la formazione di un precipitato rosso-mattone. OSSIDO RAMEOSO Saggio con reattivo di Benedict Il saggio è particolarmente sensibile per gli zuccheri. Il reattivo è in grado di ossidare anche a-idrossialdeidi e a-idrossichetoni. Il saggio è simile a quello adoperato con il reattivo di Fehling (se positivo si forma Cu2O) Preparazione del reattivo di Benedict: Sciogliere 86,5 g di citrato di sodio diidrato e 50 g di carbonato di sodio anidro in circa 350 ml di H2O e addizionare una soluzione di 8,65 g di CuSO4.5H2O in 50 ml di H2O, agitando. Diluire con H2O la miscela fino al volume di 500 ml ed eventualmente filtrare. Esecuzione del saggio: Introdurre in una provetta 4 ml del reattivo e 2-3 gocce del composto in esame, o una quantità equivalente di composto solido sciolto nella minima quantità di H2O o EtOH, e quindi scaldare la soluzione risultante all'ebollizione per 1-2 minuti. La formazione di un precipitato da giallo a rosso è indicativo della positività del saggio per la funzione aldeidica. Saggio con Acido Cromico Questo reattivo non è specifico per le aldeidi in quanto, oltre ad ossidare rapidamente le aldeidi ad acidi carbossilici, ossida anche gli alcooli primari e secondari; i chetoni invece generalmente non subiscono ossidazione. 2CrO3 + H2O 3 RCHO + Cr2O7= + 8H+ Cr2O7= + 2H+ 3 RCOOH + 2 Cr+++ + 4H2O Reattivo: 1 g di anidride cromica viene disciolto in 1 ml di H2SO4 conc. e la soluzione risultante è diluita con 3 ml di acqua. Saggio con reattivo di Shiff (Saggio della fucsina) Il reattivo di Schiff in presenza di aldeidi sviluppa una colorazione rossovioletta caratteristica (la reazione è data solo dalle aldeidi e pertanto e distintiva tra aldeidi e chetoni). p-ROSANILINA FUCSINA Reattivo: 100 ml di soluzione di p-rosanilina cloridrato (fucsina) allo 0,1% vengono trattati con 3 ml di soluzione acquosa satura di sodio bisolfito; si lascia riposare per 1 ora e si addizionano 2 ml di HCl concentrato. Rosso - Violetto
Documenti analoghi
saggi di riconoscimento dei fenoli
 Questo saggio, positivo per le aldeidi, non è dato dai chetoni, ad
eccezione di quelli sostituiti sul carbonio in posizione a rispetto al
carbonile con gruppi ossidrilici, alcossilici o dialchilamm...
Questo saggio, positivo per le aldeidi, non è dato dai chetoni, ad
eccezione di quelli sostituiti sul carbonio in posizione a rispetto al
carbonile con gruppi ossidrilici, alcossilici o dialchilamm...