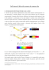Modulo A Cap. 1
Transcript
Modulo A Cap. 1
CAP 1 STRUTTURA DELL’ATOMO TEORIA QUANTISTICA DELLA MATERIA QUANTIZZAZIONE DEI RAGGI DELLE ORBITE TEORIA QUANTISTICA DELLA MATERIA Il modello della struttura atomica di Bohr prevede che ogni elettrone possa ruotare solo su un’orbita ben determinata in modo tale che il prodotto della quantità di moto (massa ¥ velocità) per la traiettoria dell’orbita sia un multiplo intero della costante di Planck. 쏋 1 dove: m◊u 2◊p◊r r n h è la quantità di moto dell’elettrone è la lunghezza della traiettoria è il raggio dell’orbita è il numero quantico totale di Bohr che aumenta in funzione dell’orbita, n = 1, 2, 3 … è la costante di Planck h = 6,625 ◊ 10–34 J ◊ s oppure h = 4,14 ¥ 10–15 e V ¥ s La formula definisce la condizione di quantizzazione di Bohr che limita e definisce ciascuna orbita dell’atomo. Siccome n è un numero intero e corrisponde a un’orbita, si deduce che il numero delle orbite (orbite quantiche) è discreto. Il modello atomico di Bohr richiede anche che un eventuale salto di elettroni possa avvenire solo fra due orbite quantiche. QUANTIZZAZIONE DEI RAGGI DELLE ORBITE L’energia totale posseduta da un elettrone ruotante su un’orbita stazionaria e la variazione dell’energia fra le orbite possono essere calcolate riferendosi al modello di Bohr. Su un elettrone gravitante su un’orbita quantica n agiscono due forze: — la forza di attrazione coulombiana elettrone-nucleo; — la forza centrifuga dovuta al moto dell’elettrone. Queste due forze si possono equilibrare, per cui: 쏋 2 dove: Z Z◊e rappresenta il numero dei protoni è la carica del nucleo Combinando la (2) con la condizione di Bohr che definisce l’orbita (equazione 1) si può calcolare la velocità dell’elettrone e il raggio dell’orbita: CAP 1 - Struttura dell’atomo 1 쏋 3 ENERGIA CINETICA – Energia dovuta al movimento. È proporzionale alla massa e al quadrato della velocità L’energia totale dell’elettrone è data dalla somma dell’ENERGIA dell’ENERGIA POTENZIALE: CINETICA e 쏋 4 ENERGIA POTENZIALE – Energia immagazzinata in virtù della posizione all’interno di un campo 쏋 5 L’energia potenziale è indicata con il segno negativo in base alle convenzioni sui potenziali delle cariche elettriche. Sostituendo nella (5) la condizione di Bohr, l’equazione dell’energia totale dell’elettrone diventa: 쏋 6 Sostituendo la formula della velocità espressa dalla (3) si ottiene: 쏋 7 E O N M L K EO EN Abbiamo detto che gli elettroni si muovono su orbite stabilite, definite da un preciso valore dell’energia posseduta dall’elettrone stesso; ogni orbita stabilisce un livello energetico che cresce passando da orbite interne a orbite esterne. Nella figura 1 viene mostrato il diagramma dei livelli energetici di un atomo avente cinque orbite (K, L, M, N, O) a ciascuna delle quali è associato un numero quantico (rispettivamente 1, 2, 3, 4, 5), e quindi un livello energetico definito dalla (7). Un elettrone che si sposta dalla sua orbita può occupare stabilmente solo un’altra orbita disponibile. Perché possa passare da un’orbita interna a una più esterna bisogna fornirgli, eccitando l’atomo dall’esterno, un’energia pari a: 쏋 EM 8 EL EK dove: EM e EK h u Fig. 1 Livelli energetici. 2 Vol. 1 - MODULO A sono livelli energetici caratterizzati dai numeri quantici 3e1 è la costante di Planck ed è pari a 6,625 ¥ 10–34 J ◊ s oppure h = 4,14 ¥ 10–15 e V ◊ s è la frequenza della radiazione emessa nel processo inverso Quando un elettrone, per una qualsiasi causa, cade da un’orbita esterna in una interna (e quindi da un livello energetico superiore a uno inferiore), dà luogo all’emissione di una radiazione di energia pari a quella calcolata con la (8), dove u è la frequenza della radiazione. Il termine h ◊ u fu chiamato da Einstein fotone. La lunghezza d’onda l della radiazione viene calcolata con la seguente relazione: 쏋 9 dove: c u è la velocità della luce pari a 2,99 ¥ 1010 cm/s è la frequenza della radiazione emessa CAP 1 - Struttura dell’atomo 3