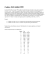istruzioni del produttore
Transcript
istruzioni del produttore
MB REDOX, 4 ml 5392 r Terreno liquido per micobatteri con indicatore cromogenico COMPOSIZIONE Terreno MB 23,2 g / Glicerolo 20 ml / Sale di Tetrazolio 24 ml / Polimixina B 50000 IU / Amfotericina B 5 mg / Carbenicillina 25 mg / Trimethoprim 2,5 mg / Acqua distillata ad 1000 ml / pH 6,6 ± 0,2 L'impiego di terreni liquidi nella diagnosi della TBC trova la sua giustificazione essenzialmente nel miglior tasso di rilevamento dei micobatteri provenienti da materiali con basso numero di batteri (1-8). Inoltre l'impiego di terreni liquidi permette di abbreviare il tempo di rilevamento rispetto ai terreni solidi. La valutazione macroscopica dei terreni liquidi è limitata dalle caratteristiche del materiale analizzato utilizzato, dovute a componenti particellari e alla formazione di torbidità. Finora esisteva la possibilità di combinare tali terreni di coltura con indicatori di crescita per la rilevazione tramite radioattività (5) o formazione di fluorescenza (9). La limitazione dei sistemi con indicatori per la rilevazione di 14CO2 risiede nei permessi necessari alla manipolazione di sostanze radioattive e nella produzione di rifiuti radioattivi a smaltimento problematico, nonché, nel caso delle reazioni con emissione di fluorescenza, nella necessità di usare una lampada a raggi ultravioletti per la lettura dei risultati. Con lo sviluppo del nuovo terreno liquido MB REDOX per la rilevazione dei micobatteri, Heipha/Biotest offre un' innovazione che rappresenta un decisivo passo avanti nel campo della diagnosi della TBC. MB REDOX è un terreno sieroso modificato, che contiene un sale di tetrazolio incolore in qualità di indicatore di crescita autosegnalante. In questo modo il sale di tetrazolio, tramite il sistema redox dei micobatteri, viene ridotto a formazan di colore che va dal rosa al rosso fino al violetto (10). Il formazan così formato non è solubile e si deposita in forma granulare sulla superficie delle cellule (10, 11,12). Dato che in un terreno liquido il Mycobacterium tuberculosis e alcune altre specie crescono di preferenza sotto forma di aggregati cellulari macroscopici (particelle), è possibile distinguerli facilmente ad occhio nudo grazie alla colorazione del formazan. In caso di numero elevato di batteri possono coesistere particelle colorate in rosa, rosso o violetto e particelle incolori o bianche. La colorazione delle particelle resta stabile per 2 settimane, dopodiché si può verificare una parziale decolorazione. MB REDOX contiene un complesso vitaminico speciale che non solo accelera notevolmente la crescita dei micobatteri ma favorisce anche la formazione di formazan. In tal modo si verifica un cambiamento di colore evidente, che rende possibile la valutazione dei risultati di MB REDOX ad occhio nudo. MB REDOX contiene inoltre la miscela di antibiotici PACT (polimixina, amfotericina B, carbenicillina e trimetoprim). 5392r-CE1-0902 Utilizzazione Come materiale di analisi si possono impiegare escreato, liquido di lavaggio broncoalveolare, liquor, succo gastrico, urina, puntura pleurica, campioni di feci o di tessuti ecc. (1). In caso di sangue intero si consiglia di effettuarne preventivamente la scomposizione. A questo scopo cellule sanguigne previamente sottoposte a centrifugazione si possono lisare e lavare con acqua distillata fino alla decolorazione. Pretrattamento Materiali prelevati in condizioni sterili possono venir impiegati senza pretrattamento. In caso di campioni di tessuto si consiglia un'omogeneizzazione preliminare. Campioni che contengono flora aggiuntiva (p. es. escreato) vengono resi liquidi e decontaminati sottoponendoli a pretrattamento con soluzione di N-acetile-L-cisteina/NaOH. A questo scopo, in una provetta da centrifuga da 30 - 50 ml si miscela un'aliquota di campione di non più di 10 ml con la stessa quantità di soluzione NALC/NaOH. Le provette vengono chiuse, agitate accuratamente e poste nell'agitatore per 20 minuti (per tassi di contaminazione superiori al 10% si consiglia un massimo di 25 minuti). Quindi la provetta viene immediatamente riempita fino ad 1 cm al di sotto del bordo con tampone fosfato di Sörensen (pH 6,8; molarità 1/15; 4,84 g di KH2PO4 + 5,53 g di Na2HPO42H2O in 1000 ml di acqua distillata) (1). Dato che la concentrazione specifica del Mycobacterium tuberculosis nel terreno è al di sotto dello 0,1, si consiglia di aggiungere 1 - 2 gocce di una soluzione di Tween 80 al 5% per una migliore centrifugazione. Dopo l'aggiunta del tampone fosfato e di 1 - 2 gocce di soluzione di Tween 80 al 5% la provetta viene immediatamente centrifugata per venti minuti ad almeno 3.300 G. La parte galleggiante viene eliminata, mentre il sedimento viene assorbito in 1 ml di soluzione salina sterile e applicato sui vari terreni di coltura (1). In alternativa si può altresì assorbire il sedimento in tampone fosfato sterile. Preparazione della coltura 0,2 - 0,5 ml di campione vengono inoculati in condizioni asettiche nel flacone di MB REDOX. L'iniezione può venir eseguita sia con una siringa monouso attraverso il setto integrato nel tappo a vite oppure con una pipetta dopo aver aperto il cappuccio del tappo a vite. Per la successiva incubazione i flaconi devono venire ben chiusi. Il materiale restante serve a inoculare altri due terreni di coltura solidi a base di tuorlo d'uovo o agar. La preparazione di un terreno colturale liquido e due solidi corrisponde alla procedura attuale della diagnostica dei micobatteri. Parallelamente viene preparata una soluzione Ziehl-Neelsen per determinare la presenza di batteri acidoresistenti. Infine le colture vengono incubate a 36 C ± 1 C. In caso di campioni di pelle, si consiglia di effettuare un'ulteriore coltura a temperatura di incubazione inferiore (30 C) (corrispondente alla temperatura ottimale di crescita del Mycobacterium marinum). Lettura dei risultati La lettura dei risultati ha luogo per la prima volta dopo 24 ore, ed in seguito almeno due volte alla settimana, facendo in modo che trascorrano da 3 a 4 giorni di incubazione fra due letture consecutive. Dopo 4 settimane si può ridurre la frequenza ad 1 lettura alla settimana. La lettura ha luogo di solito in due fasi: 1. Valutazione del liquido e del sedimento senza inclinare la provetta. 2. Valutazione delle particelle sedimentate dopo leggera inclinazione della provetta. 5392r-CE1-0902 La presenza di particelle colorate dal rosa fino al rosso o al violetto (anche nel sedimento) indica la presenza di micobatteri. Si può verificare inoltre in alcuni casi una colorazione dell'intero MB REDOX. Una torbidità biancastra del terreno di coltura deriva nella maggior parte dei casi da una torbidità propria del materiale inoculato. Nel caso siano presenti particelle incolori, MB REDOX va esaminato, dopo altre 24 ore di incubazione, alla ricerca di cambiamenti di colore, al più tardi al momento della lettura successiva. Se necessario si può preparare a questo punto una soluzione per batteri acidoresistenti. I micobatteri a crescita rapida sono rilevabili in MB REDOX di regola dopo 2 - 5 giorni. Micobatteri a crescita lenta invece richiedono da 5 a 20 giorni - in rari casi anche un tempo maggiore. L'incubazione delle colture viene conclusa di solito dopo otto settimane. Nel caso di campioni nei quali esami microscopici precedenti abbiano rilevato batteri acidoresistenti, è opportuno incubare le colture negative per 12 settimane al massimo. Al momento dell'ultima lettura bisogna agitare fortemente il campione, per poter riconoscere eventuali particelle colorate presenti nel sedimento. La crescita del Mycobacterium tuberculosis e di alcune altre specie di micobatteri si manifesta sotto forma di particelle colorate in rosa, rosso o violetto. La crescita del Mycobacterium avium e di altre specie di micobatteri si manifesta sotto forma di particelle molto piccole, che provocano invece la colorazione dal rosa al violetto del terreno di coltura. Un'eventuale contaminazione dovuta a flora aggiuntiva non inibita dagli antibiotici PACT si manifesta sotto forma di intorbidimento dal rosa al violetto, e in rari casi può presentare formazione di particelle. In caso di intorbidimento o formazione di particelle dopo 24 ore di incubazione bisogna esaminare il campione alla ricerca di eventuali contaminazioni o di micobatteri a crescita rapida. A questo scopo MB REDOX viene agitato e se ne applica una goccia su di un supporto e su di un terreno di coltura solido TBC. Quindi si inocula una piastra di agar sangue come segue: la prima goccia viene applicata nel primo quadrante senza strisciarla, mentre la seconda goccia viene ripartita nei tre quadranti rimanenti strisciandola. Questo procedimento favorisce lo sviluppo dei micobatteri a crescita rapida e allo stesso tempo migliora la possibilità di differenziazione di eventuale flora aggiuntiva nello striscio. Il supporto viene lasciato asciugare per tutta la notte su di un banco da lavoro sterile sotto luce UV. Il giorno dopo il preparato viene fissato, sottoposto a colorazione Ziehl-Neelsen ed esaminato alla ricerca di batteri acidoresistenti. In alternativa si possono fissare i preparati per 10 minuti a 120 C o per 20 minuti a 80 C e colorarli subito dopo. La valutazione dei risultati avviene secondo la seguente tabella. Preparato microscopico Risultato Crescita su agar sangue + - + +* Contaminazione Micobatteri a crescita rapida *In caso di risultato positivo è necessario eseguire una conferma della presenza di batteri acidoresistenti nella coltura in agar sangue. Nel caso in cui nel preparato microscopico siano stati rilevati altri tipi di batteri oltre ai batteri acidoresistenti, il materiale della provetta originale può venir trattato nuovamente con 4 ml di soluzione Nacetile-L-cisteina/NaOH. Ad avvenuta neutralizzazione (vedere il paragrafo "Pretrattamento") e centrifugazione si può di nuovo inoculare un MB REDOX con il sedimento così trattato. Parallelamente va richiesto un campione fresco dal paziente in questione. In alternativa alla colorazione Ziehl-Neelsen si può eseguire anche la colorazione con Auramina O, più sensibile. Considerare in questo caso che i micobatteri a crescita rapida non presentano una colorazione brillante, ma si colorano unicamente in rosso arancio (14). Dagli MB REDOX positivi si possono prelevare particelle intere colorate tramite una pipetta sterile monouso (pipetta Pasteur). Il materiale viene esaminato alla ricerca di batteri acido resistenti ed identificato e differenziato tramite sonde DNA o tecnica PCR (15). 5392r-CE1-0902 In alternativa si possono anche centrifugare accuratamente gli MB REDOX positivi con un Vortex ed esaminarli alla ricerca di batteri acidoresistenti. Se viene rilevata la presenza di batteri acidoresistenti, 3 ml della coltura ben miscelata vengono prelevati e centrifugati in coppette Eppendorf a 13.000 G. Seguendo le indicazioni del fabbricante è possibile utilizzare il sedimento per l'identificazione delle specie tramite sonde DNA. La soluzione di coltura rimanente viene riportata a 4 ml con aggiunta di terreno MB REDOX fresco ed impiegata per la coltura di materiale per il test di sensibilità. Koemoth descrive l'isolamento di micobatteri tramite filtraggio del terreno e utilizzazione del filtro per il test della sonda DNA (16). Con tale metodo non è necessario utilizzare ultracentrifughe. Procedimento ulteriore Negli isolati primari, oltre all'identificazione delle specie va eseguito un test di sensibilità (1), che può venir eseguito su terreni di coltura sia solidi che liquidi. È in preparazione un sistema apposito su base REDOX. BIBLIOGRAFIA 1. DIN (1988): 58943 Teil 3, sowie Neuausgabe Normenentwurf 1995. 2. DZK (1991): Die Bakteriologie der Tuberkulose. Pneumologie 45, 453-473. 3. Salfinger, M., Kafader, F. M. (1992): Mycobacteriaceae, mikrobiologische Diagnose v. F. Burkhardt, 269-289. 4. Mitchison, D. A., Allen, B. W., Lambert, R. A. (1973): Selective media in the isolation of tubercle bacilli from tissues. J. Clin. Path., 250-252. 5. Libonati, J. P. et al (1986): Evaluation of the recovery and contamination rates of mycobacteria in the Bactec system using increased media volume, increased inoculum size and new antimicrobial supplement (PANTA), ASM Meeting Washington D.C. 6. Rüsch-Gerdes, S. et al (1987): Untersuchungen mit dem System Bactec 460, 2. Isolierung von Myc. tuberculosis aus Sputum - Vergleich der radiometrischen und konventionellen Methode. Praxis Klin. Pneumologie 41, 219-222. 7. Naumann, L. (1992): Vergleichende Untersuchungen von flüssigen und festen Nährböden in der Tuberkulosediagnostik. Klinisches Labor 38, 325-329. 8. Naumann, L. (1995): Cultural Detection of Mycobacteria. Biotest Bulletin, Vol. 5 No. 2, 177-180. 9. Stitt, David T., Kodsi, Salma E. (1994): A rapid method for the growth and detection of Mycobacteria in clinical and stock cultures. 94th General Meeting ASM, Las Vegas, May 23-27. 10. Bochner, Barry R., Savageau, Michael A. (1977): Generalized Indicator Plate for Genetic, Metabolic and Taxonomic Studies with Microorganisms. Appl. and Environment Microbiology 33, 434-444. 11. Malatyan, M. N., Birynzowa, V. I. (1965): Localisation of dehydrogenase activity in mitochondrial analogs of bacterial cells. Dokl. Akad. Nauk. SSSR 160, 1182-1184. 12. Vanderwinkel, E., Murray, R. G. E. (1962): Organelles intracytoplasmiques bactériens et site d'activité oxydo-réductrice. I. Ultrastruct. Res. 7, 185-199. 13. Tokars, J.I. et al (1996): US Hospital Mycobacteriology Laboratories: Status and Comparison with State Public Health Department Laboratories. J. Clin. Microbiology 34, 680-685. 14. Flournoy, O. J. (1993): Non acidfastness of Mycobacterium fortuitum. Med. Sc. Res. 21, 665. 15. Reischl, U., Naumann, L. (1996): Molekularbiologische Methoden zum Nachweis von Mykobakterien. Fortschritte der Medizin 114, Nr. 18-19, 237-241. 16. Koemoth, Pierre P., Fraselle, Robert H., Corea de Brito, Jean-Marc A. (1996): Filtration of Bactec 7H12 Broth Cultures for Identification of Mycobacterium tuberculosis Complex by Accuprobe. J. of Clinical Microbiology 34, 230-231. 5392r-CE1-0902 17. Naumann, L., et al (1997): Evaluierung des MB REDOX - Ein neues Flüssigmedium im Vergleich zu festen Medien und dem Bactec 460 TB. J. Lab Med 21 (1), 031-034. 18. Naumann, L., et al (1997): Neue schnelle kulturelle Nachweismethoden im Mykobakterienlabor. Mikrobiologe 7. Jg., 123-125. 5392r-CE1-0902