Il ciclo mestruale
Transcript
SEZIONE DELL’OVAIO Follicoli e corpo luteo nelle varie fasi di evoluzione estradiolo progesterone FUNZIONE ENDOCRINA DELL’OVAIO • Corticale: – epitelio germinativo: origine celomatica, funzione controversa, rischio degenerativo neoplastico – lo stroma (cell. Leidig): secrezione di androgeni (T, A2), cellule tecali (E2-Pg), – i complessi follicolari: dal 5° mese di vita alla menopausa: follicoli primordiali, preantrali, antrali, maturi o di De Graaf, atresici. • Midollare: – residuo della porzione maschile della gonade primitiva: vasi, nervi, scarso connettivo. Residui del mesonefro FUNZIONE ENDOCRINA DELL’OVAIO CRESCITA E MATURAZIONE FOLLICOLARE • Follicolo primordiale: dal 5° mese di vita fetale – atresia prepubere: 2.000.000 → 300.000 • Follicolo primario: (granulosa, teca) • Follicolo secondario (a 3 cicli dall’ovulazione) con la formazione della teca interna ed esterna • Follicolo terziario o antrale (a 2 cicli dall’ovulazione) • Reclutamento finale (4-5 follicoli all’inizio del ciclo ovulatorio) • Follicolo maturo o di De Graaf: preovulatorio FUNZIONE ENDOCRINA DELL’OVAIO FOLLICOLO OVARICO - MORFOLOGIA • • • • Ovocita, circondato dalla zona pellucida Cellule della granulosa: steroidogenesi Fluido follicolare: fluidi proteici, ormoni Teca interna: all’esterno delle cellule della granulosa (m. Slaviansky), vascolarizzata • Teca esterna: cell. muscolari e connettivali • Entrambe le teche follicolari hanno una funzione steroidogenetica FUNZIONE ENDOCRINA DELL’OVAIO FOLLICOLO OVARICO - FUNZIONE • Proliferazione delle cellule della granulosa • Formazione della cavità antrale • Differenziazione della teca interna ed esterna • Ripresa della divisione meiotica (iniziata nella vita prenatale e fermata a diplotene della metafase, riprende solo dopo il picco preovulatorio dell’LH) • Crescita e maturazione dell’ovocita con la formazione della membrana esterna (zona pellucida) SVILUPPO DEL FOLLICOLO • Reclutamento finale (1-5 follicoli) 1-4 g. • Recettori FSH sulle cellule della granulosa ( < 50° M.) • Recettori LH cellule teca • Formazione del liquido follicolare e dell’antro • Formazione del follicolo dominante STEROIDOGENESI OVARICA Periodo follicolare – Teca (LH – Granulosa (FSH Androgeni (A4 – T) aromatasi estrogeni CONTROLLO ORMONALE DELLE CELLULE DELLA GRANULOSA FSH 1. 2. 3. 4. Effetto mitogeno (con E) Differenziazione morfologica Induzione recettoriale (colesterolo, LH, PRL) Secrezione di sostanze non steroidee (inibina, IGF1, PG) 5. Induzione della steroidogenesi (colesterolo, androgeni-estrogeni) 6. Stimolazione dell’attività generale della cellula CONTROLLO ORMONALE DELLE CELLULE DELLA GRANULOSA LH 1. 2. 3. 4. Azione antimitotica Stimolazione della steroidogenesi Stimolazione dei recettori di membrana Secrezione di sostanze non steroidee (PG, renina-angiotensina, altre sostanze vasoattive) CONTROLLO ORMONALE DELLE CELLULE DELLA GRANULOSA ESTROGENI 1. Proliferazione delle cellule della granulosa (sinergia con FSH): < aromatasi < progesterone 2. Crescita dei follicoli di piccola e media grandezza 3. Costituzione dell’antro ANDROGENI 1. Con FSH crescita del follicolo 2. Senza FSH atresia del follicolo CONTROLLO ORMONALE DELLE CELLULE DELLA GRANULOSA GLUCOCORTICOIDI • Inibizione della crescita del follicolo PROGESTERONE • Inibizione della crescita del follicolo ( > FSH, aromatasi, feed-back neg) STEROIDOGENESI OVARICA Periodo luteinico Vascolarizzazione delle cell. Granulosa – Teca-luteiniche A - E – Gran-luteiniche Prog. - E STEROIDOGENESI OVARICA LUTEOLISI – PGF2a • > dell’azione del LH sulle cellule luteiniche • Blocco dell’effetto stimolate della PRL • Riduzione dei recettori per l’LH – Estradiolo (> sintesi delle PGF2a e del Prog) Estrogeni • Comparsa dei caratteri sessuali femminili • Modificazioni quali/quantitative degli organi sessuali • Proliferazione endometrio • Crescita della ghiandola mammaria e apparato produttore del latte • Proliferazione cellulare nei tessuti costitutivi di organi e tessuti Progesterone • • • • • Modificazioni secretive endometrio Inibizione contrazioni uterine Maturazione secretive tube di Falloppio Maturazione apparato secretore del latte Riassorbimento di sodio, cloro, acqua Estrogeni in età fertile • 17 beta estradiolo - prodotto dall’ovaio x 90% - piccola produzione surrenalica - conversione periferica di estrone e testosterone • Estrone - maggiore produzione ovarica - prodotto in quantità inferiore - emivita breve, clearance veloce - piccola quantità da conversione androgeni • Estriolo - deriva dal metabolismo di estradiolo ed estrone Estrogeni in menopausa • 17 beta estradiolo - produzione prevalente extra ovarica - ↓ livelli circolanti - ↓ clearance per legame SHGB • Estrone - è più abbonadante - deriva dalla conversione del testosterone ed androstenedione nel tessuto adiposo e altri distretti ↓ Attività biologica sui tessuti bersaglio Il ciclo mestruale La mestruazione è l’evento più appariscente del ciclico, composto sfaldamento dell’endometrio, in risposta all’interazione dell’azione degli ormoni prodotti dall’asse ipotalamo-ipofisi ovaio. Per lunghezza del ciclo mestruale si intende il numero di giorni che intercorrono tra il primo giorno di una mestruazione ed il primo del ciclo successivo. La durata media di un ciclo mestruale è di 28 giorni, un range di normalità compreso tra 25 e 30. I cicli che intercorrono con un intervallo inferiore ai 21 giorni sono denominati polimenorroici, quelli che compaiono ad una distanza maggiore di 35 giorni, oligomenorroici. Il ciclo mestruale è tipicamente più irregolare intorno agli estremi della vita riproduttiva, menarca e menopausa, per la presenza di cicli anovulatori e di un inadeguato sviluppo follicolare. La fase luteale ha una lunghezza relativamente costante di 14 giorni (± 1). La variabilità della lunghezza del ciclo deriva dalla durata diversa della fase follicolare del ciclo, con un range da 10 a 16 giorni. Fase follicolare La fase follicolare inizia il primo giorno del ciclo e dura sino all’ovulazione. Questa fase è caratterizzata dallo sviluppo follicolare a livello ovarico e da una bassa temperatura basale. La follicologenesi inizia durante gli ultimi giorni del ciclo mestruale precedente e si prolunga fino allo “scoppio” del follicolo maturo, dominante al momento dell’ovulazione. Fase follicolare Il declino nella produzione di steroidi da parte del corpo luteo e la drammatica caduta delle concentrazioni di inibina A ed inibina B consentono all’FSH di crescere durante gli ultimissimi giorni del ciclo mestruale precedente. Questi eventi consentono il reclutamento di una coorte di follicoli in ciascun ovaio, uno dei quali è destinato a diventare dominante e ad “ovulare” nel ciclo successivo. Fase follicolare Una volta iniziato il ciclo mestruale, i livelli di FSH iniziano a decrescere, dopo un picco, per effetto del feed-back negativo degli estrogeni e per l’effetto negativo dell’inibina prodotta dal follicolo in via di sviluppo. L’FSH attiva l’enzima aromatasi presente nelle cellule della granulosa, che convertono gli androgeni in estrogeni. Fase follicolare Il declino dei livelli di FSH comporta la trasformazione in senso androgenico del microambiente all’interno dei follicoli adiacenti al follicolo dominante. Inoltre, le cellule della granulosa del follicolo in via di sviluppo secernono una quantità di peptidi che inibiscono lo sviluppo dei follicoli adiacenti. Nello sviluppo del follicolo dominante sono stati descritti tre stadi: reclutamento, selezione e dominanza. Durante i giorni 1-4 viene reclutata una coorte di follicoli dal pool, in risposta all’FSH. Tra il 5° ed il 7°giorno viene selezionato soltanto un follicolo che “ovulerà” ed i rimanenti follicoli andranno incontro ad atresia. Dall’8° giorno, solo un follicolo esercita la propria dominanza promuovendo la sua stessa crescita e sopprimendo la maturazione degli altri follicoli ovarici. Fase follicolare Durante la fase follicolare, il livello di estrogeni serici cresce parallelamente all’aumentare delle dimensioni del follicolo ed all’incremento del numero delle cellule della granulosa. I recettori per l’FSH sono presenti esclusivamente sulla membrana delle cellule della granulosa. L’aumento dell’FSH durante gli ultimi giorni della fase luteale, induce un incremento dei recettori per l’FSH stesso ed, in ultima istanza, un aumento nella secrezione di estradiolo da parte delle cellule della granulosa. Fase follicolare L’aumento del numero dei recettori per l’FSH è dovuto ad un aumento del numero delle cellule della granulosa e non ad un aumento del numero dei recettori (circa 1500) per ogni singola cellula. L’aumento della secrezione di estradiolo appare aumentare il numero di recettori per l’E2 stesso. In presenza di E2, l’FSH stimola la formazione di recettori per l’LH sulle cellule della granulosa permettendo la secrezione di piccole quantità di progesterone e di 17-OH-Progesterone, che esercitano un feed-back sull’ipofisi per aumentare la secrezione di LH. Fase follicolare I recettori per l’LH sono localizzati sulle cellule della teca, ma non su quelle della granulosa, durante tutti gli stadi del ciclo. L’LH stimola la produzione di androstenedione ed, in minor misura, di testosterone, da parte delle cellule della teca. L’androstenedione viene trasportato nelle cellule della granulosa, aromatizzato ad estrone ed, infine, convertito in estradiolo, dall’enzima 17-betaidrossi-deidrogenasi tipo I. Questo processo è noto come teoria delle due cellule, o delle due gonadotropine, della sintesi degli estrogeni ovarici. Fase follicolare Il follicolo primordiale è circondato da un singolo strato di cellule della granulosa ed è fermo allo stadio di diplotene della prima divisione meiotica. Dopo la pubertà, il follicolo primordiale si ingrandisce e si trasforma in follicolo pre-antrale, ed in seguito, con lo sviluppo di una cavità ripiena di fluido, in follicolo antrale e poi preovulatorio. Fase follicolare Per l’azione dell’enzima 5-alfa-reduttasi, i follicoli preantrali ed i follicoli antrali in fase precoce, producono in maggiore quantità androstenedione e testosterone rispetto agli estrogeni. L’enzima 5-alfa-reduttasi è responsabile della trasformazione di testosterone in diidro-testosterone. Una volta ridotto, il diidrotestosterone non può più essere aromatizzato. Tuttavia, il follicolo dominante produce una grande quantità di estrogeni, principalmente estradiolo, il che fa “shiftare” il microambiente follicolare da androgenico ad estrogenico. Questo meccanismo gioca un ruolo importante nella selezione del follicolo dominante e nel determinare l’atresia nei rimanenti follicoli. Fase follicolare Lo sviluppo del follicolo verso lo stadio preantrale è gonadotropino-indipendente, ma ogni ulteriore stadio di sviluppo richiede l’interazione delle gonadotropine. La secrezione di gonadotropine è regolata dal GnRH ipotalamico, dagli ormoni steroidi e da vari peptidi rilasciati dal follicolo dominante. Fase follicolare L’FSH è elevato durante la fase follicolare precoce e quindi comincia a decrescere fino al momento dell’ovulazione. Al contrario, l’LH è basso durante la fase follicolare precoce ed inizia a salire durante la fase follicolare media a causa del feed-back positivo esercitato dalla concentrazione crescente di estrogeni. Affinchè si inneschi il feed-back positivo sull’LH è necessario che i livelli di E2 siano maggiori di 200pg/ml per circa 50 ore. Fase follicolare Nel fluido follicolare sono presenti numerose sostanze che regolano il microambiente ovarico e la steroidogenesi nelle cellule della granulosa: steroidi, ormoni ipofisari, proteine plasmatiche, proteoglicani e fattori ovarici non steroidei. In particolare i fattori di crescita come l’IGF1 e l’IGF2, l’EGF giocano un ruolo importante nello sviluppo e nella maturazione follicolare. Fase follicolare La concentrazione degli steroidi ovarici è maggiore nel fluido follicolare rispetto al plasma. Esistono due diverse popolazioni di follicoli antrali: quelli grandi, con diametro maggiore di 8 mm e quelli piccoli, con diametro inferiore agli 8 mm. Nei follicoli grandi, la estrogeni e progesterone è bassa. Nei follicoli piccoli, androgeni sono maggiori grandi. concentrazione di FSH, alta, quella di prolattina i livelli di prolattina e di che nei follicoli antrali Ovulazione L’ovulazione avviene approssimativamente 10-12 ore dopo il picco dell’LH. L’LH “surge” inizia in seguito ad un marcato aumento della concentrazione di Estradiolo prodotto dal follicolo preovulatorio. Affinchè si realizzino le condizioni per l’innesco del feed-back positivo degli estrogeni, il follicolo dominante deve avere un diametro ecografico > 15 mm. Il picco dell’LH avviene 34-36 ore prima dell’ovulazione ed è un predittore abbastanza preciso del timing dell’ovulazione stessa. Ovulazione L’LH “surge” stimola la luteinizzazione delle cellule della granulosa e la sintesi di progesterone. Inoltre stimola la ripresa della meiosi e la fine della divisione dell’ovocita con l’espulsione del primo globulo polare. Le prostaglandine e gli enzimi proteolitici come la collagenasi e la plasmina, aumentano in risposta all’LH ed al Progesterone. Sebbene il meccanismo non sia ancora del tutto noto, è certo che si verifica un’attivazione degli enzimi proteolitici e delle prostaglandine, che “digeriscono” il collagene della parete follicolare, determinando un rilascio “esplosivo” del complesso ovocita-cumulo ooforo. Ovulazione Il punto del follicolo dominante più vicino alla superficie ovarica, dove avviene la “digestione” della parete è noto come stigma. Nella donna, l’ovulazione avviene probabilmente in maniera random in un’ovaio, non preferenzialmente in quello controlaterale nel ciclo successivo, come invece avviene nei primati. Ovulazione Le concentrazioni delle prostaglandine E ed F e dell’acido diidroeicosatetranoico (HETE) raggiungono un picco nel fluido follicolare immediatamente prima dell’ovulazione. Le prostaglandine stimolerebbero gli enzimi proteolitici e l’HETE l’angiogenesi e l’iperemia. Ovulazione I livelli di Estradiolo cadono drammaticamente immediatamente prima del picco dell’LH. Questo sarebbe il risultato di una diretta inibizione nella sintesi dell’estradiolo da parte del progesterone. Il meccanismo responsabile della caduta dei livelli di LH dopo l’ovulazione non è ancora noto. Potrebbe essere determinata dalla fine del feedback positivo da parte degli estrogeni, piuttosto che ad un esaurimento del contenuto di LH nell’ipofisi. Fase luteale Dopo l’ovulazione, le cellule della granulosa continuano ad ingrandirsi, diventano apparentemente vacuolizzate ed iniziano ad accumulare un pigmento giallastro, la luteina. Le cellule della granulosa luteinizzate si uniscono alle neonate cellule teco-luteiniche e circondano lo stroma ovarico, formando la struttura nota come corpo luteo. Il corpo luteo è un organo endocrino transitorio, secernente prevalentemente progesterone, la cui funzione primaria è quella di preparare l’endometrio già stimolato dagli estrogeni per l’impianto dell’ovocita fertilizzato. Fase luteale La lamina basale si dissolve e i capillari invadono lo strato delle cellule della granulosa come risposta alla secrezione di fattori angiogenici da parte delle cellule della granulosa e della teca. Otto o nove giorni dopo l’ovulazione, nel momento atteso per l’impianto, si raggiunge il picco della vascolarizzazione. Questo corrisponde al picco dei livelli serici del progesterone e dell’estradiolo. La cavità centrale può accumulare sangue e trasformare la struttura in corpo luteo emorragico. Fase luteale La funzione del corpo luteo declina alla fine della fase luteale, a meno che non venga prodotta la gonadotropina corionica umana. Se non intercorre la gravidanza, il corpo luteo va incontro a luteolisi per influenza dell’estradiolo e delle prostaglandine, e si forma un tessuto cicatriziale, il corpo albicante. Fase luteale Il meccanismo tramite il quale il corpo luteo regola la secrezione di steroidi non è completamente chiarito. La regolazione può essere determinata in parte dal pattern di secrezione dell’LH e dai recettori per l’LH stesso o dalle variazioni dei livelli degli enzimi che regolano la produzione di steroidi. Anche il numero di cellule della granulosa che si formano durante la fase follicolare e la quantità di LDL-colesterolo prontamente disponibile potrebbero giocare un ruolo. Fase luteale La funzione del corpo luteo comincia a venir meno 9-11 giorni dopo l’ovulazione. L’esatto meccanismo tramite il quale il corpo luteo va incontro alla fine della sua funzione non è completamente noto. Probabilmente gli estrogeni giocano un ruolo importante nella luteolisi. Estradiolo iniettato direttamente nell’ovaio contenente il corpo luteo induce la luteolisi, mentre non si osserva alcun effetto se l’estradiolo viene iniettato nell’ovaio controlaterale. Fase luteale Tuttavia, l’assenza di recettori per gli estrogeni nelle cellule luteiniche umane non supporta l’ipotesi di un ruolo chiave degli estrogeni nella regressione del corpo luteo. La prostaglandina F2-alfa ha effetto luteolitico attraverso la sintesi di endotelina 1 che inibisce la steroidogenesi e stimola il rilascio di un fattore di crescita, il fattore alfa di necrosi tumorale (TNFa), che induce apoptosi. L’ossitocina e la vasopressina esercitano il loro effetto con meccanismo autocrino/paracrino. Fase luteale Infine, la capacità dell’LH nel regolare il numero dei propri recettori potrebbe essere determinante nel determinare la fine della fase luteale. Non tutti gli ormoni vanno incontro a marcate fluttuazioni durante il ciclo mestruale normale. Per esempio, gli androgeni, i glucocorticoidi e gli altri ormoni ipofisari, ad eccezione ovviamente dell’LH e dell’FSH, subiscono soltanto minimi cambiamenti. Flusso mestruale In assenza di gravidanza, i livelli di ormoni steroidei cominciano a scendere parallelamente al declino della funzione del corpo luteo. Il calo del progesterone comporta una costrizione delle arteriole spirali ed una ischemia tissutale dovuta ad una contrazione dell’apporto ematico agli strati superficiali dell’endometrio, lo strato spongioso e quello compatto. Flusso mestruale L’endometrio rilascia prostaglandine che causano contrazione dello strato muscolare e lo sfaldamento del tessuto endometriale. L’infusione di prostaglandine F2 alfa durante la fase luteale induce necrosi endometriale e sanguinamento. L’uso di inibitori della prostaglandin-sintetasi induce una diminuzione della quantità del sanguinamento mestruale ed è comune nella pratica clinica. Flusso mestruale Il fluido mestruale è costituito principalmente da tessuto endometriale desquamato, globuli rossi, essutato infiammatorio ed enzimi proteolitici. Entro due giorni dall’inizio della mestruazione, gli estrogeni stimolano la rigenerazione dell’epitelio superficiale endometriale. Gli estrogeni prodotti dai follicoli ovarici in crescita, causano vasocostrizione prolungata che favorisce la formazione di coaguli sui vasi endometriali messi a nudo. Flusso mestruale La durata media del flusso mestruale è tra 4 e 6 giorni, ma il range normale varia tra 2 ed 8 giorni. La quantità della perdita ematica è di circa 30 ml, una quantità maggiore di 80 ml è da considerarsi anormale. Endometrio Le variazioni nelle concentrazioni di estrogeni e progesterone durante il corso del ciclo mestruale hanno effetti caratteristici sull’endometrio. E’ possibile “datare” istologicamente l’endometrio. Le ghiandole durante la fase proliferativa sono strette, tubulari e sono presenti mitosi e pseudostratificazioni. Lo spessore dell’endometrio varia tra 0.5 e 5 mm. In un ciclo classico di 28 giorni, l’ovulazione avviene il 14°giorno. Flusso mestruale Intorno al 16° giorno assumono un aspetto accumulo di glicogeno dell’epitelio ghiandolare centro delle cellule. del ciclo, le ghiandole pseudostratificato con nella porzione basale ed i nuclei dislocati nel Con il procedere dei giorni le ghiandole diventano più tortuose e dilatate. Flusso mestruale Intorno al 21°- 22° giorno, lo stroma endometriale inizia a diventare edematoso. Intorno al 27° giorno è presente una marcata infiltrazione linfocitaria e lo strato più superficiale dello stroma endometriale appare come un unico foglietto compatto di cellule simil-deciduali. Il 28° giorno ha inizio il flusso mestruale. Cervice uterina Il muco secreto dalle ghiandole dell’endocervice subisce delle variazioni con il mutare delle concentrazioni degli ormoni steroidei. Immediatamente dopo la mestruazione, il muco cervicale è denso e viscoso. Durante la fase follicolare tardiva, per effetto dei livelli crescenti di estradiolo, il muco diventa abbondante, filante, chiaro, trasparente. Al microscopio, il muco cervicale assume un caratteristico aspetto a foglia di felce. Cervice uterina Dopo l’ovulazione, con l’aumentare dei livelli di progesterone, il muco cervicale ridiventa scarso, spesso, viscoso ed opaco. Amenorrea - Definizione • Assenza di mestruazioni all’età di 16 aa in presenza di caratteri sessuali secondari normali → amenorrea primaria • Assenza di mestruazioni per 3-6 mesi in una donna che in precedenza ha avuto ciclo mestruale → amenorrea secondaria Classificazione delle amenorree primitive • Etiologia uterina • Etiologia ovarica • Etiologia ipotalamica (Ipogonadismo ipogonadotropo) • Agenesie Mulleriane (es. Sindrome di Rokitansky). • • Sindrome dell’ovaio policistico. Fallimento ovarico prematuro (POF, in genere di origine genetica, es. S. di Turner). • • • Perdita di peso Esercizio intenso (es. ballerine) Idiopatica Classificazione delle amenorree primitive • Pubertà ritardata • Ritardo costituzionale • Etiologia ipofisaria • • • Iperprolattinemia Ipopituitarismo Tumori (craniofaringioma, glioma, germinoma) • • • Malattie croniche debilitanti Perdita di peso Patologie endocrine (tiroidee, S. di Cushing). • Danno ipotalamo/ipofisario (ipogonadismo) Cause sistemiche Classificazione delle amenorree secondarie • Etiologia uterina • Etiologia ovarica • Etiologia ipotalamica (ipogonadismo ipogonadotropo) • • S. di Asherman Stenosi cervicale • S. dell’ovaio policistico; POF (genetico, autoimmune, infettivo, post radio/chemio terapia). • • • • • Perdita di peso Esercizio fisico Malattie croniche Cause psicogene Idiopatica Classificazione delle amenorree secondarie • Etiologia ipofisaria • Danno ipotalamo/ipofisario (ipogonadismo) Cause sistemiche • Iperprolattinemia • Ipopituitarismo • S. di Sheehan • • • • • Tumori (craniofaringioma) Irradiazione del cranio Traumi del capo Sarcoidosi Tubercolosi • Malattie croniche debilitanti • Perdita di peso • Patologie endocrine (della tiroide, S: di Cushing).
Documenti analoghi
Il ciclo ormonale femminile
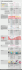 Ogni mese l'FSH stimola
l'ovaio a produrre
estrogeni che promuovono
la crescita di un follicolo
dominante e la liberazione
di un ovulo maturo
(ovulazione).
Ogni mese l'FSH stimola
l'ovaio a produrre
estrogeni che promuovono
la crescita di un follicolo
dominante e la liberazione
di un ovulo maturo
(ovulazione).
Casa di Montalbano – Punta Secca (Rg)
 perché ha “garantito” il reclutamento di un n° elevato di ovociti:
Produzione di molti embrioni per ciclo (prima della legge 40);
Selezione ovocitaria (dopo la legge 40).
perché ha “garantito” il reclutamento di un n° elevato di ovociti:
Produzione di molti embrioni per ciclo (prima della legge 40);
Selezione ovocitaria (dopo la legge 40).
le basi biologiche della riproduzione, il ciclo mestruale, le
 produzione di GnRH (gonadotropin releasing--hormon)
produzione di GnRH (gonadotropin releasing--hormon)
Scarica il pdf con la minireview completa
 agisce infatti legandosi in modo competitivo ai recettori degli
estrogeni presenti nei nuclei delle cellule di vari organi bersaglio, comprendenti l’ipotalamo, l’ipofisi e l’ovaio, ma anche l’endom...
agisce infatti legandosi in modo competitivo ai recettori degli
estrogeni presenti nei nuclei delle cellule di vari organi bersaglio, comprendenti l’ipotalamo, l’ipofisi e l’ovaio, ma anche l’endom...
Ciclo Mestruale e Irregolarità Mestruali.ppt
 - alla produzione degli steroidi femminili
I fenomeni avvengono all’interno dell’ovaio ma
dipendono direttamente dalle gonadotropine e dalla
regolazione del sistema riproduttivo in generale
- alla produzione degli steroidi femminili
I fenomeni avvengono all’interno dell’ovaio ma
dipendono direttamente dalle gonadotropine e dalla
regolazione del sistema riproduttivo in generale
cecilia benetti
 del tasso di estrogeni fino al raggiungimento della soglia basale (15
pg/ml). I tassi di progesterone sono invece ridotti per tutta la fase
proestrale, con la sola eccezione delle ultime 12-24 ore,...
del tasso di estrogeni fino al raggiungimento della soglia basale (15
pg/ml). I tassi di progesterone sono invece ridotti per tutta la fase
proestrale, con la sola eccezione delle ultime 12-24 ore,...






