RUOLO DELLE DISTORSIONI NEL SITO ATTIVO DI EMO
Transcript
RUOLO DELLE DISTORSIONI NEL SITO ATTIVO DI EMO
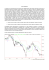
RUOLO DELLE DISTORSIONI NEL SITO ATTIVO DI EMO-PROTEINE M. Leone INFM e Dip. di Scienze Fisiche ed Astronomiche dell’Università’ Via Archirafi, 36 – 90123 Palermo Le porfirine ed altri tetrapirroli rivestono una larga varietà di ruoli come cromofori dei complessi proteici. Alla loro capacità di svolgere differenti funzioni, in differenti proteine, contribuisce in maniera determinante la larga flessibilità nella conformazione del macrociclo, che deve adattarsi alle numerose interazioni non-covalenti imposte dagli amminoacidi delle catene laterali della matrice proteica. Appare quindi evidente l’interesse per lo studio delle proprietà strutturali ed elettroniche delle porfirine, e della loro interazione con le proprietà dinamiche del sito attivo. A questo scopo, un valido metodo di indagine è costituito dallo studio, in funzione della temperatura, delle bande di assorbimento Q0 e Qv (650-450 nm). Queste bande sono presenti in tutti i derivati delle emoproteine, sebbene molto meno intense della elettronicamente permessa e largamente studiata banda di Soret (450-350 nm). La banda Q0 é attribuita ad una transizione π->π* del gruppo eme, che appare non permessa dalle regole di selezione elettronica in simmetria planare (D4h) del complesso eme-ferro-legante; la banda Qv è invece considerata come una struttura vibrazionale della prima. Un’analisi teorica (V. Sanfratello, Tesi di Laurea) della forma di riga delle bande Q in termini di accoppiamenti Herzberg-Teller, ha permesso di evidenziare come, data la loro natura, le bande Q presentino: i) una intensità fortemente dipendente da distorsioni strutturali, che possono allontanare il sistema dalla originaria simmetria D4h; ii) una struttura del profilo di assorbimento largamente dominata da accoppiamenti non Franck-Condon con i modi vibrazionali locali del sito attivo, che sono all’origine della Qv; iii) un allargamento omogeneo minore di quello associato con la banda di Soret, che permette quindi di meglio evidenziare le strutture fini vibrazionali. Questo strumento di indagine si è rivelato particolarmente adatto allo studio degli effetti del legame del gruppo eme con leganti di grosso ingombro sterico (”bulky ligands”), come l’acido nicotinico, il cui interesse generale nasce dalle sostanziali modificazioni conformazionali indotte all’interno del sito attivo di emoproteine. Un’analisi comparativa di derivati di differenti proteine, legati all’acido nicotinico e al monossido di carbonio, ha mostrato la presenza di distorsioni del gruppo eme, che dipendono sia dalle singole proteine sia dalla natura del legante. L’insieme degli effetti indotti dalla sostituzione del legante sulle proprietà dinamiche e strutturali delle varie emoproteine è stato messo a confronto con le proprietà funzionali, come evidenziate dalle costanti cinetiche di legame.