cromatografia in fase liquida ad elevate prestazioni (hplc)
Transcript
cromatografia in fase liquida ad elevate prestazioni (hplc)
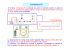
CROMATOGRAFIA IN FASE LIQUIDA AD ELEVATE PRESTAZIONI (HPLC) Nella moderna cromatografia liquida, sono richieste pressioni di pompaggio di diverse centinaia di atmosfere, per raggiungere velocità di flusso sufficienti a permettere una buona separazione in colonne impaccate con particelle di diametro variabile dai 3 ai 10 µm. Come conseguenza l’equipaggiamento di una moderna apparecchiatura per HPLC è notevolmente più costoso rispetto a quello della cromatografia classica. SCHEMA GENERALE DI UNO STRUMENTO PER HPLC 1, 1’) RISERVA DELLA FASE MOBILE 2, 2’) POMPA A) PRE-COLONNA 3) PROGRAMMATORE DI GRADIENTE B) CAMERA PER LA SOMMINISTRAZIONE DI (FACOLTATIVO) UN REATTIVO COLORANTE 4) FILTRO C) INTEGRATORE 5) INIETTORE D) MISURATORE DI FLUSSO 6) COLONNA CROMATOGRAFICA E) RACCOGLITORE DI FRAZIONI 7) RIVELATORE 8) REGISTRATORE RISERVA DELLA FASE MOBIILE Un moderno apparato per HPLC è equipaggiato con uno o più contenitori in vetro o acciaio, generalmente bottiglie, contenenti 500 ml o più di solvente. La preparazione della soluzione e la sostituzione di un contenitore di solvente, però, producono bolle e scorie, che se entrassero in colonna potrebbero causare uno slargamento delle bande; inoltre si avrebbe anche una compromissione dell’efficienza del sistema di pompaggio: per questo sono in genere, subito dopo le bottiglie, sono presenti dei dispositivi per degassare i solventi e le soluzioni eluenti, e filtri di vetro poroso per eliminare eventuali particelle indisciolte. Ricordiamo che l’analisi può prevedere l’utilizzo di uno o di più fasi mobili. Un’eluizione con un singolo solvente di composizione costante viene detta isocratica. Nella eluizione tramite gradiente invece, due o più solventi di differenti polarità, vengono mescolati in proporzioni prestabilite: l’eluizione in gradiente generalmente aumenta l’efficienza della separazione, così come la variazione della temperatura influisce sulla gas cromatografia. CARATTERISTICHE GENERALI DELLA FASE MOBILE La scelta della fase mobile è strettamente legata alla fase stazionaria (dipende cioè dal tipo di cromatografia che si vuole effettuare); tuttavia vi sono dei requisiti generali che una simile fase deve possedere: 1) 2) 3) 4) 5) 6) 7) bassa viscosità (minore è la viscosità, maggiore è l’efficienza) immiscibilità con la fase stazionaria capacità di solubilizzare il campione compatibilità col rivelatore elevata purezza non essere tossico, corrosivo e volatile essere limpido, stabile, poco costoso e facilmente reperibile POMPE Le caratteristiche cui devono soddisfare le pompe impiegate per l’HPLC sono molto restrittive e includono: generazione di elevate pressioni d’ingresso mantenere un flusso di eluente costante e riproducibile velocità di flusso variabili in un range di 0.1-10 ml/min la riproducibilità del flusso non deve variare più dello 0.5% resistenza alla corrosione verso una grande varietà di solventi Sono impiegati due tipi di pompe meccaniche: pneumatiche e meccaniche. Le pompe meccaniche sono semplici, poco costose e danno un flusso costante e lineare; hanno però come inconveniente che la velocità del flusso è molto influenzata dalla viscosità della fase mobile. Inoltre non sono adatte ad analisi in gradiente. Nelle pompe meccaniche si evita l’utilizzo di un gas compresso, ma per il resto hanno gli stessi pregi e difetti delle pompe meccaniche. PROGRAMMATORE DEL GRADIENTE DI ELUIZIONE Questo è il dispositivo deputato variazione della composizione della fase mobile e quindi alla creazione del gradiente; in pratica si collegano qui le riserve dei due solventi ed una valvola li miscela a comando nel modo desiderato, per poi inviare la miscela alla pompa. FILTRI Per impedire che granelli di materiale estraneo entrino in colonna, è bene inserire, a monte dell’iniettore, un sistema di filtri. In questo caso si impiegano filtri con pori di diametro compreso fra i 5 e i 10 µm, che non provocano significative cadute di pressione e bloccano al contempo le particelle indesiderate. SISTEMA DI INIEZIONE Sebbene nella cromatografia in fase liquida sia spesso usata l’iniezione tramite siringa attraverso un setto costituito di materiale elastomero, questa procedura non è molto riproducibile e si può usare solo a pressioni di lavoro non troppo elevate. In questo caso il flusso del solvente viene bloccato per permettere il caricamento del campione in testa alla colonna, tramite una siringa. Comunque il metodo di caricamento più usato in HPLC è quello che usa un sistema a valvola (sampling loop): qui il campione viene introdotto appena a monte della colonna e viene trascinato in essa dalla fase mobile senza interruzione di flusso. La caratteristica principale del sistema di iniezione tramite loop è l’alta riproducibilità dei volumi iniettati. PRECOLONNA o COLONNA DI GUARDIA Per evitare che inquinanti entrino in colonna oggi si usano delle precolonne, riempite con lo stesso materiale della fase stazionaria della colonna, ma a granulometrie più grossa e in forma pellicolare. COLONNE Le colonne per HPLC sono di solito costruite in acciaio, ma esistono anche in vetro borosilicato, impiegate soprattutto quando si lavora a pressioni non troppo elevate. La lunghezza delle colonne varia da 10 a 30 cm e il diametro interno da 4 a 10 mm. Le colonne sono generalmente impaccate con particelle di diametro variabile dai 5 ai 10 µm, e arrivano generalmente a contenere dai 40000 ai 60000 piatti teorici per metro di lunghezza. Il materiale di riempimento è trattenuto in colonna da due setti porosi di acciaio inox sinterizzato: quello in testa trattiene le particelle solide eventualmente sospese nella fase mobile, quello in coda trattiene le particelle più fini della fase stazionaria. CARATTERISTICHE GENERALI DELLA FASE STAZIONARIA Utilizzando una fase stazionaria solida, ricordiamo che qui la granulometrie delle particelle è di molto inferiore a quella utilizzata in cromatografia liquida classica; ciò consente di migliorare le prestazioni, ed in particolare di incidere sull’efficienza della separazione, dato che diminuzione delle diametro medio comporta una minore altezza dei piatti teorici. In HPLC vengono principalmente usate: PARTICELLE PELLICOLARI → sono costituite da un nucleo non poroso di forma sferica (solitamente in vetro) rivestito da un sottile strato di materiale microporoso. Il diametro interno della particella risulta 40 – 50 µm, mentre le colonne impiegate in questo caso hanno lunghezza di 50 – 100 cm. MICROPARTICELLE POROSE → possono essere di forma irregolare o sferiche a diverse porosità, e si utilizzano con colonne tanto più corte quanto più fine è la loro granulometria. Assicurano un’elevata efficienza e una buona capacità TERMOSTATO DELLA COLONNA Per molte applicazioni non è necessario il controllo preciso della temperatura e le colonne vengono fatte operare a temperatura ambiente. Spesso comunque i migliori cromatogrammi si ottengono mantenendo la temperatura della colonna costante e vicina alla temperatura ambiente. I moderni strumenti sono equipaggiati con riscaldatori di colonne che possono mantenere una temperatura in un range variabile da qualche decina di gradi a 150°C. RIVELATORI Per l’HPLC non sono disponibili rivelatori universali ed altamente sensibili, come quelli impiegati per la gas cromatografia. Quindi il sistema di rivelazione usato dipende dalle esigenze dettate dalla natura del campione. Esistono diversi tipi di rivelatori o detector: Detector UV-Visibile → è il più utilizzato in HPLC: consiste in un piccolissimo spettrofotometro usato per mettere i evidenza da presenza e la concentrazione di molecole in gradi di assorbire radiazioni nell’UV-Vis. Sono molto stabili, sensibili e possono essere utilizzati nell’eluizione in gradiente (ricordando che nella scelta della fase mobile bisogna avere l’accortezza di scegliere un solvente che non assorba in questo intervallo spettrale). Generalmente vengono indagate lunghezze d’onda che vanno dai 200 ai 280 nm poiché molti gruppi funzionali dei composti organici assorbono in questa regione. La sorgente usata può essere il mercurio ma si usano anche filamenti in tungsteno o deuterio equipaggiati con filtri di interferenza che eliminano le radiazioni indesiderate. Detetctor Diode-Array → qui la sorgente è una lampada al deuterio, che fornisce un fascio di luce UV che passa attraverso la cella contenente il campione prima di giungere al monocromatore; successivamente, grazie a un fotomoltiplicatore a serie di diodi, si effettua la misurazione su tutto il campo delle lunghezze d’onda in tempo reale! Viene quindi mostrato l’intero spettro di assorbimento di un analita che entra in colonna. Detector a indice di rifrazione → si basa sul cambiamento dell’indice di rifrazione del solvente causato dalle molecole di analita. In contrasto con la maggior parte dei rivelatori precedentemente indicati, questo è meno selettivo perché l’indice di rifrazione è in generale meno specifico per le varie sostanze e può essere influenzato anche da soluti presenti nella fase mobile. Lo svantaggio di questo tipo di rivelatore è inoltre una limitata sensibilità, oltre che la poca selettività. Detector a fluorescenza → questo dispositivo misura l’intensità della radiazione fluorescente emessa da particolari classi di composti quando vengono eccitate da una radiazione UV o da un laser. Hanno buona sensibilità, sono molto selettivi, insensibili agli sbalzi termici, alla velocità di flusso e sono compatibili con analisi in gradiente. ************************ La HPLC rappresenta l’evoluzione strumentale della cromatografia in fase liquida su colonna classica; in questa maniera, infatti, in pochi minuti si effettuano separazioni di miscele anche molto complesse, ed è anche possibile, in certe condizioni, determinare automaticamente la composizione quantitativa ed ottenere informazioni decisive sulla natura delle sostanze analizzate. In HPLC il flusso della fase mobile (rappresentato da un liquido a bassa viscosità) viene assicurato da un sistema di pompe, e la rivelazione è automatica all’uscita della colonna. Dunque, purchè una specie chimica non sia eccessivamente volatile e a condizione di trovare il solvente adatto per portarla in soluzione, noi possiamo condurre con successo un’analisi HPLC; inoltre questa tecnica ci permette di adottare tecniche di separazione diverse, a patto di utilizzare i dispositivi adatti (soprattutto i rivelatori). Possiamo quindi condurre: cromatografia di adsorbimento (liquido – solido) cromatografia di ripartizione (liquido – liquido) cromatografia di esclusione cromatografia di scambio ionico cromatografia su fase legata cromatografia su fase chirale cromatografia a fase inversa CROMATOGRAFIA DI ADSORBIMENTO (LIQUIDO – SOLIDO) Nella cromatografia liquido – solido le molecole del campione vengono adsorbite in misura diversa dalla fase stazionaria, distribuendosi perciò fra questa e la fase mobile. FASE STAZIONARIA Il più usato è il gel di silice microgranulare, costituito da particelle porose con diametri medi di 3, 5, 10 e 20 µm (quello da 10 µm è il più usato perché assicura selettività e velocità operativa, accompagnati da un’elevata efficienza) Le particelle possono essere: di forma irregolare → offrono una maggiore superficie di scambio, per cui dovrebbero assicurare maggiore efficienza; tuttavia comportano maggiori difficoltà nell’impaccare uniformemente le colonne di forma sferica Ricordiamo che il gel di silice ha proprietà leggermente acide, e quindi è adatta a trattenere preferenzialmente composti basici. In alternativa si può usare, essendo meno costoso, il gel di silice pellicolare, costituito da microfibre di vetro con diametro di 37 – 43 µm, rivestite di un sottile strato uniforme di gel di silice poroso. Altro materiale usato è l’allumina, che ha caratteristiche leggermente basiche, al contrario del gel di silice, al quale rappresenta quindi una buona alternativa. Può esistere in forma microgranulare o in forma pellicolare. FASE MOBILE Le interazioni chimico–fisiche che consentono la separazione dei componenti di una miscela in colonna vengono interpretate come una competizione fra le molecole del soluto e quelle del solvente (fase mobile) nell’occupare i siti di adsorbimento che si trovano sulla fase stazionaria e all’interno dei micropori che la caratterizzano. In tal modo, maggiore è l’affinità della fase mobile per quella stazionaria, meno i componenti vengono adsorbiti e più rapida risulta la loro eluizione. In generale diciamo che il tutto si gioca sulla polarità: con fasi stazionarie poco polari come quelle precedentemente descritte si usano solventi o miscele di solventi poco polari (comunque la scelta ultima va effettuata in base alla natura delle sostanze da separare) CROMATOGRAFIA DI RIPARTIZIONE (LIQUIDO – LIQUIDO) Nella cromatografia liquido – liquido la separazione dei componenti di una miscela avviene in conseguenza della diversa ripartizione di questi ultimi fra le due fasi liquide; la velocità con cui una molecola si sposta in una colonna è quindi collegata al suo coefficiente di ripartizione. FASE STAZIONARIA La fase stazionaria è costituita da un liquido altobollenti che viene depositato sotto forma di film sottile su un supporto inerte, solitamente costituito da granuli di gel di silice o di allumina, terre di diatomee o altro. Anche in questo caso i supporti possono essere microgranulari o pellicolari; questi ultimi assicurano alte efficienze ai flussi relativi, ma hanno basse capacità. FASE MOBILE Deve essere immiscibile con la fase stazionaria, ma soprattutto, prima di entrare in colonna deve essere saturo di fase stazionari per evitare fenomeni di trascinamento. Tuttavia l’inconveniente di questa tecnica è proprio il fatto che si ha una rapida perdiat di fase stazionaria durante l’analisi; inoltre non è possibile operare in gradiente di polarità ed è per questo che tale tecnica oggi trova poca applicazione. CROMATOGRAFIA A FASE LEGATA Qui la fase stazionaria liquida si trova legata chimicamente a un supporto solido, formando un tutt’uno di particolare stabilità. Questa tecnica rappresenta un’evoluzione della Cromatografia liquido – liquido, in quanto ne supera l’inconveniente principale, ovvero la non trascurabile perdita di fase stazionaria che si verifica durante le ripetute eluizione. FASE STAZIONARIA Il supporto a cui vengono legate chimicamente le molecole della fase stazionaria può essere costituito da: ♥ microparticelle di gel di silice ♥ microsfere di vetro rivestite da un sottile film di gel di silice ♥ microsfere di vetro tal quali I primi due supporti danno le fasi dette pellicolari, mentre le microsfere di vetro rappresentano un supporto molto resistente agli aggressivi chimici. Altri materiali sono: ♥ microparticelle di zircone ♥ microparticelle di materiali contenenti legami C–F ♥ microparticelle di gel di silice legate a una fase polimerica ♥ microparticelle polimeriche a base di PS – DVB (polistirene –divinilbenzene) o di PMA (polimetacrilato) Per realizzare la fase legata si interviene chimicamente sugli ossidrili liberi che si trovano sulla superficie di questi supporti, introducendo particolari radicali: Ragioni di carattere sterico fanno sì che, in generale, solo il 50 % degli OH liberi venga effettivamente modificato; la fase mantiene perciò una certa attività residua che può essere minimizzata previo ulteriore trattamento con reagenti costituiti da molecole di piccole dimensioni. Con la reazione (1) si ottengono fasi legate molto sensibili all’idrolisi, per cui non possono essere utilizzate in solventi acquosi. Con le reazioni (2) e (3) si ottengono fasi più stabili all’idrolisi nelle normali condizioni d’impiego (pH = 2 – 8). Con la reazione (4) si ottengono fasi molto stabili anche a temperature elevate. FASE MOBILE Per consuetudine viene definita cromatografia normale quella che comporta l’impiego di un eluente non polare insieme con una fase stazionaria polare: in questo caso i componenti di una miscela vengono eluiti in ordine di polarità crescente perchè le molecole polari possiedono una maggiore affinità per la fase stazionaria. Quando invece si usano fasi stazionarie apolari (come ODS) abbinati a eluenti polati si parla di cromatografia inversa, ed è questa la tecnica che si usa in generale parlando di cromatografia a fase legata! Alcune tecniche particolari CROMATOGRAFIA DI ESCLUSIONE Anche in questa tecnica il gel che costituisce la fase stazionaria attua una selezione sterica delle molecole del campione escludendo quelle le cui dimensioni siano superiori ad un certo valore limite, facendole eluire per prime. Le molecole di minori dimensioni riescono invece a penetrare nei pori del gel, e vengono trattenute in misura maggiore quanto più piccole sono le loro dimensioni, e quindi il loro peso molecolare. L’applicazione di questa tecnica all’HPLC si è resa possibile con la realizzazione di gel semirigidi e rigidi in grado di conservare stabilità sotto elevate pressioni di eluente. FASE STAZIONARIA Si possono distinguere in due categorie: gel semirigidi e rigidi. I gel semirigidi sono in genere dei polimeri dal grado di ramificazione elevato, per conferire al materiale un basso potere di rigonfiamento e più elevate resistenze alla pressione degli eluenti. Questi gel vengono per lo più utilizzati con solventi poco polari (come benzene), mentre vanno evitati solventi molto apolari o molto polari I gel rigidi sono costituiti da silice o fibre di vetro microporose. Data la maggiore rigidità rispetto ai precedenti, queste fasi sono più stabili e quindi più adatte a lavori di precisione, e più facilmente impaccabili in colonna. Possiedono però una minore capacità e non possono essere usate con soluzioni a pH superiore a 7,5 per evitare eventuali pericoli di corrosione. Uno svantaggio poco trascurabile nell’uso di questi materiali è dovuto alla presenza di OH liberi sulla superficie delle particelle sia di vetro che della silice. Ciò provoca fenomeni di adsorbimento a volte non desiderati. Il blocco di questi centri attivi può essere effettuando silanizzando il materiale, oppure legando agli ossidrili gruppi polari tramite ponti eterei FASE MOBILE I criteri seguiti sono gli stessi della cromatografia classica. CROMATOGRAFIA DI COPPIA IONICA Una valida alternativa all’utilizzo delle resine nella separazione di composti ionici o ionizzabili consiste nel modificare il campione, sopprimendone in qualche modo la ionicità, e nel procedere alla sua separazione con altre tecniche cromatografiche; in particolare, per gli elettroliti sia forti che deboli, si usa la cromatografia in coppia ionica. In questo caso gli ioni interessati vengono accoppiati con un controione particolare, in modo da formare con esso composti apolari. La cromatografia viene poi generalmente effettuata con un sistema a fasi inverse. In pratica qui si trasforma la specie ionica, accoppiandola con un opportuno controione in grado di neutralizzarne la carica elettrica, ottenendo un complesso sostanzialmente non polare; la situazione può essere rappresentata da questo equilibrio: (Campione) ± + (Contrione)± ↔ [Campione – Controione]0 La cromatografia, come detto, viene condotta in un sistema a fasi inverse, utilizzando una fase stazionaria non polare legata, e un solvente acquoso contenente il controione a concentrazioni varianti da 0,005 M e 0,01 M. È però possibile condurre una cromatografia normale utilizzando una fase stazionaria polare contenente il controione, e una fase mobile polare o poco polare saturata dello stesso controione. DERIVATIZZAZIONE Lo stesso discorso fatto per la GC può essere fatto per l’HPLC. Qui, come agente derivatizzate, si usa il fluorodinitrobenzene: apolare, aggiunto in eccesso alla soluzione eluente esce prima dell’analita polare. Questa tecnica permette di: ridurre la polarità di una molecola di rivelare tramite spettroscopia UV sostanze che non presentano gruppi cromoforo. CROMATOGRAFIA HPLC CHIRALE Solitamente la separazione degli enantiomeri di un prodotto chirale viene effettuata mediante derivatizzazione con un reagente enantiomericamente puro sì da preparare diastereomeri stabili che vengono poi separati mediante HPLC achirale e successivamente riportati chimicamente ai due enantiomeri singoli del prodotto di partenza. Lo sviluppo recente e significativo fi fasi stazionarie chirali (CSP) ha contribuito fortemente all'uso della HPLC come una metodica efficiente per la separazione di enantiomeri, nel caso in cui si ottengano buoni valori di enantioselettività (a) e fattore di risoluzione (Rs). Le tecniche di HPLC chirale rivestono una grande importanza sia per la separazione analitica sia per l'isolamento preparativo dei composti enantiopuri. Questo successo è sicuramente spiegato dalla capacità unica dell'HPLC chirale di fornire entrambi gli enantiomeri alla volta. Questo può essere realizzato direttamente utilizzando delle fasi stazionarie chirali (CSPs) dove un selettore chirale è chimicamente legato, oppure rivestito, o ancora, legato alla superficie di un supporto materiale. Nella cromatografia chirale, il processo di riconoscimento enantioselettivo avviene per formazione di complessi diastereomerici temporanei che si creano tra l'analita e l'agente chiro-discriminante. Delle informazioni cruciali riconducibili al meccanismo delle separazioni cromatografiche sono ottenibili attraverso la modellizzazione, la chimica quantistica e tutti i calcoli teorici annessi che sono, oggigiorno, un pratico e prezioso strumento per l'esplorazione dei modelli atomistici dell'enantioselezione. L’enantioseparazione di un racemato può essere fatta per via chimica o per via strumentale e la tecnica strumentale più usata è la high performance liquid chromatografy (HPLC). Per la separazione di enantiomeri o isomeri ottici in cromatografia è necessario un mezzo chirale. Vi sono due approcci di separazione: diretto; indiretto; Il primo si ottiene derivatizzando il composto in esame con un reagente chirale separando i due diastereoisomeri ottenuti per via chimica o mediante cromatografia non chirale . Il secondo approccio si ottiene legando un selettore chirale ad un supporto solido, ottenendo così una fase stazionaria chirale o aggiungendo alla fase mobile il selettore chirale usando quindi per la separazione una fase stazionaria non chirale. Comunque il sistema più usato prevede l’impiego di fasi stazionarie chirali. Gli enantiomeri sono molecole asimmetriche di cui uno degli isomeri è l’immagine speculare dell’altro. Finché si trovano in ambiente simmetrico essi hanno proprietà chimiche e fisiche identiche e non possono essere distinti. Questo cambia appena interagiscono in ambienti o con mezzi asimmetrici. Per la separazione di enantiomeri è necessario creare un ambiente chirale. Se il metodo di separazione è la cromatografia liquida, sono disponibili quattro tecniche elencate in ordine di importanza decrescente: • L’uso di una fase stazionaria solida chirale (CSP). • La formazione di diastereoisomeri tramite la derivatizzazione per mezzo di un reagente chirale a monte della cromatografia non chirale. • L’uso di una fase mobile chirale, che si ottiene dall’aggiunta di una piccola quantità di reagente chirale nell’eluente. • L’uso di una fase stazionaria liquida chirale. L’impaccamento di una colonna LC, costituito da silice, viene rivestito con un film liquido, un composto otticamente puro che non deve essere solubile nella fase mobile utilizzata. Questa tecnica non può essere eseguita facilmente per questo è stata sostituita dalla CSP. La loro separazione usando una fase stazionaria chirale si spiega con la possibilità che si formino temporaneamente degli addotti diastereoisomerici o complessi tra la molecola chirale e la CSP o la fase stazionaria liquida chirale. Per ottenere l’enantioseparazione è necessario che le due forme dell’isomero differiscano nel numero dei punti di attacco o nelle energie di legame. Queste interazioni o legami non-permanenti possono essere dipolo-dipolo (indotto o permanente), legame idrogeno, interazioni p -p oppure del tipo orbitale d (complesso con i metalli). Ovviamente la separazione è possibile se uno degli enantiomeri è ritenuto da tre interazioni di legame e l’altro solo da due. Questo principio è conosciuto come regola dei tre punti di Dalgliesh. (Fig 1) Per caratterizzare la separazione di due enantiomeri viene utilizzato in genere il fattore di separazione a ; a è dato dal rapporto tra i fattori di capacità k’’, che sono misure di ritenzione. a = k’2/k’1 = (tR2-t0)/(tR1-t0) con k’2³ k’1 tR= tempo di ritenzione di un composto; t0= tempo morto. La risoluzione di racemati è alla base di uno studio completo di un farmaco chirale.