avocetta - CISO-COI
Transcript
avocetta - CISO-COI
AVOCETTA Journal of Ornithology founded by Sergio Frugis CISO ISSN 0404-4266 Centro Italiano Studi Ornitologici Volume 35 - N. 1/2 - 2011 Avocetta 35: 3-12 (2011) Le comparse dell’aquila di Bonelli Aquila fasciata in Italia nord-occidentale: eventi eccezionali o normale erratismo? GIANFRANCO ALESSANDRIA1, GIOVANNI BOANO2 1 2 Corso Caio Plinio 70, 10127 Torino, [email protected] Museo Civico di Storia Naturale - Via San Francesco di Sales 188, 10022 Carmagnola (TO) In memoria del Conte Alberto Ferrero La Marmora che per primo illustrò dettagliatamente questa specie. Abstract Aquila fasciata - - INTRODUZIONE Accipitriformes Aquila fasciata et al. - - et al. et al. - et al. et al. et al. et al. - et al. © 2011 CISO - Centro Italiano Studi Ornitologici 3 Alessandria e Boano et al. et al. et al - - - RISULTATI METODI - - - Figura 1 Historical distribution of the records Before 1950 the data are grouped by 100 and 50 years periods, after for decades. 4 Le comparse dell’Aquila di Bonelli in Italia nord-occidentale Tabella 1 Montly subGen Feb Mar Apr Mag Giu Lug Ago Set Ott Nov Dic s.d. 0 2 3 2 4 0 1 1 13 6 4 1 5 Imm Tot - ... presa il 15 settembre 1897 a Rovegno (Bobbio) sui monti oltre padani, che vidi gli Oddi... et al. Segnalazioni antecedenti al 1950 - - - colto - ... Nello scorso anno (16 agosto 1891) cacciando nei monti presso Traversella un’aquila che, per le dimensioni e proporzioni mi è sembrata appartenere a questa specie, mi è passata a breve distanza”. - di avere avuto dei giovani di questa specie presi in Val di Magra giovani non vidui erranti sono sempre giovani nell’abito caratteristico - ... più facile averlo dalla Liguria e dalla Toscana... - - - Le vendeur m’assura que de ces oiseaux 5 Alessandria e Boano ? Figura 2 ap of distribution and phenology chart en furent trouvés deux individus dans un bois très-épais dans la province du Mugello, mais qu’il ne fut possible - et al. - Segnalazioni successive al 1949 - in litt. - 6 - Le comparse dell’Aquila di Bonelli in Italia nord-occidentale - et al. et al. - - DISCUSSIONE - - in litt. 2006, et al. et al. in litt. - et al. - et al. - - - - - - - et al. et al. 7 Alessandria e Boano - - - Ringraziamenti Aquila fasciata - - - - - - BIBLIOGRAFIA Hieraaetus fasciatus Hieraaetus fasciatus - - 8 Le comparse dell’Aquila di Bonelli in Italia nord-occidentale Hieraaetus fasciatus Falco Bonelli - Hieraaetus fasciatus Aquila fasciata Hieraaetus fasciatus, - - - - Aquila fasciata. 2006. - Hieraaetus fasciatus - - Aquila fasciata - - Toni Mingozzi 9 Alessandria e Boano Appendice 1 cords in North Italy and Tuscany from 1861 to 2010. Anno Giorno, mese Località e provincia Regione N, età, sesso List of the Bonelli’s eagle reDocumentazione Materiale esaminato et al et al. et al. et al. et al. et al. et al. et al. et al. et al. et al. continua 10 Le comparse dell’Aquila di Bonelli in Italia nord-occidentale Anno Giorno, mese Località e provincia Regione N, età, sesso Documentazione Materiale esaminato et al. . et al. Uncertain or erroneous observations. Anno Giorno, mese Località e provincia Regione N, età, sesso Documentazione Materiale esaminato obs obs. obs 11 Alessandria e Boano Observations not included in the above list (changes in national borders or uncertain locality). Anno Giorno, mese Località Nazione N, età, sesso Documentazione Materiale esaminato in litt. NOTE et al in litt et al. in litt. in litt Aquila chrysaetos vidi un’aquila che per proporzioni e dimensioni mi parve… Buteo/Pernis A. fasciata. - 12 Avocetta 35: 13-17 (2011) A comparison of two methods for monitoring migrating broad-winged Raptors approaching a long water crossing MICHELE PANUCCIO¹,², MARCO GUSTIN³, GIUSEPPE BOGLIANI¹ ¹ Università di Pavia, Dipartimento di Scienze della Terra e dell’Ambiente - Via Ferrata 1, 27100 Pavia (Italy) ([email protected]) ² MEDRAPTORS (Mediterranean Raptor Migration Network) - Via Mario Fioretti 18, 00152 Rome (Italy) ³ LIPU (Lega Italiana Protezione Uccelli) - Via Trento 49, 43122 Parma (Italy) Abstract October 2007. Raptors concentrate at this site before crossing the Channel of Sicily en route to Africa (130 km). We used and compared two different census methods in order to limit the problem of double-counting of migrating raptors. A total of 510 and 299 individuals rence), the second one consists in considering the maximum number of raptors observed together for each observation day (maximumdaily-count). Raptors observed were almost juveniles and immatures (inexperienced individuals). For short-toed snake eagle Circaetus gallicus, booted eagle Aquila pennata Buteo buteo ditions affected observed numbers of these species at the site, although they did so similarly for both methods. Results show that, at Marettimo, it is not possible to make an accurate count of inexperienced broad-winged raptors approaching the long water crossing. For this reason we suggest to consider as an activity index the daily count of the maximum number of birds of the same species observed together INTRODUCTION During migration Accipitriformes mostly use soaring water and to reduce energetic costs (Kerlinger 1989). The wing morphology of raptors plays a role in the evolution of migration strategies; in particular, species with relatively broad wings (low aspect ratio) are less suited to undertake the crossing of large bodies of water while the same, heavticular Kerlinger (1989) proposed the aspect ratio [(Wing Span)2/(Wing Area)] as one of the most important morphologic features explaining water crossing tendency of raptors, while other authors highlighted the weight differ2007, Pennycuik 2008). As a result, large soaring raptors in small numbers during spring and autumn migration in Central Mediterranean. Observations of broad-winged inexperienced and/or young individuals (Agostini 2005, Agostini and Malara 1997, Agostini et al. 2000, 2004a, 2004b, 2005). ence its decision of whether or not to attempt a crossing: the morphology, the distribution of landmarks and leading lines, the length of the water crossing, the physiologiand previous experiences; moreover, weather conditions strongly affect water crossing behaviour (Kerlinger 1985, 1989, Agostini et al. 1994, 2002, 2003, 2005, Agostini and Duchi 1994, Agostini and Panuccio 2003a, 2003b, Klaassen et al. 2010, Meyer et al. 2000, 2003, Panuccio 2005, 2011, Thorup et al. 2003). Thus, it is not surprising that at some sites, accurately counting migrating rapin such cases Accipitriformes sometimes interrupt migration, disappear from view and pass again through the study and split up when faced with a water crossing and someet al © 2011 CISO - Centro Italiano Studi Ornitologici 13 Panuccio et al. ontory), were previously considered unsuitable for counting migrating raptors (Agostini 2005, Agostini et al. 1994, Agostini and Duchi 1994, Agostini and Panuccio 2003a, 2003b, Panuccio 2005, Panuccio et al. 2004, Premuda et al. 2008). N MC the Channel of Sicily between the island of Marettimo and of migrating raptors are regularly observed during autumn (Agostini et al August and the end of September large numbers of black kites Milvus migrans Pernis apivorus and marsh harriers Circus aeruginosus are observed. Later in the season, a smaller number of raptors, mostly juvenile short-toed snake eagles Circaetus gallicus are recorded (Agostini et al. 2004a, 2005). The aim of this paper is to verify whether it is possible to make an accurate count of large soaring raptors migrating through the island of Marettimo en route to Africa, and to compare two different methods for doing so. CP M Sicily CB Tunisia STUDY AREA AND METHODS The island of Marettimo (Fig. 1) is located 30 Km off (Tunisia). Observations were made from the 3rd to the 15th October 2007 using a single watch point located along the main ridge of the island at an elevation of 500 m above sea level. Two observers with binoculars and telescopes were employed. Observations were made from 9:00 (solar time) until dusk. Two different methods were used to count raptors. et al et al. 2007) and hereafter called “all-occurrence”: it consists in counting raptors when they passed over the watch point; in order to avoid counting them again, birds were followed with binoculars opposite direction of the presumed optimal migration were et al. 2000, Panuccio 2005). The second method, hereafter called “maximum-dailycount”, consists to count the maximum number of individboth cases, we noted whether any individual birds could be ing at the site were counted only if they were not observed the following morning. 14 150 km Figure 1 Peninsula, CP = Circeo Promontory, MC = Mount Conero). We tested the hypothesis that local weather conditions affect the count of migrating raptors. We considered the different results with the two census methods: the shorttoed snake eagle, the booted eagle Aquila pennata and the Buteo buteo el (GLM) with negative binomial distribution was applied using as independent factors: i) wind direction, ii) wind speed (km/h), iii) temperature (°C), iv) air pressure (mbar) and v) humidity (%) to explain variation in daily counts of each species. These variables were obtained from the meteorological station of the Trapani Airport every day at 13.20. Wind direction was divided into two categories according to the most common winds in the study period: northerly and southerly winds. The GLM was repeated with the results of both census techniques. A Spearman test was run to avoid collinearity between the 5 variables; air pressure was excluded from the analysis since it correlates with wind direction (Rho=-0.63; P<0.05). We veri- A comparison of two methods for monitoring migrating broad-winged Raptors Table 1. Numbers of raptors counted by two census methods. ALL-OCCURRENCE MAXIMUM-DAILY-COUNT Short-toed snake eagle Circaetus gallicus 210 123 Aquila pennata 44 23 10 6 1 1 SPECIES Lesser spotted eagle Aquila pomarina Aquila fasciata 1 1 Buteo buteo 144 53 Pernis apivorus 11 10 33 32 51 44 2 2 Pallid harrier Circus macrourus 1 1 Circus pygargus/macrourus 2 2 510 299 Egyptian vulture Neophron percnopterus Milvus migrans Marsh harrier Circus aeruginosus Circus cyaneus TOTAL RESULTS AND DISCUSSION During the entire survey, we counted 510 raptors with the “all-occurrence” method and 299 with the “maximum-daily count” method, for a total of 12 species (Tab. 1). For comparisons involving more than 10 birds, the differences - - served undertaking the water crossing toward Africa in only three cases. enced the number of individuals recorded, to a similar extent for both census techniques (Tab. 2). Wind speed in the case of short-toed snake eagle and booted eagle and creasing wind speeds numbers of short-toed snake eagles and booted eagles decreased, while with southerly winds recorded. These results are expected, since raptors tend to avoid water crossings when wind conditions require an extra amount of energy consumption, as such as when strong winds or headwinds are blowing (Meyer et al. 2000, 2003, Panuccio 2011, Panuccio et al. numbers were also positively correlated with temperatures; however, since temperature decreased as the days passed (Rho=-0.72; P<0.01), we suggest that this correlation could be related to the migration timing of the two daily counts similarly for both methods probably because raptors do not reach the island of Marettimo with unfavourable wind conditions, as in these cases they do not undertake the short water crossing between Sicily and Marettimo (approx. 30 km). Previous studies which were carried out at the same site showed that other species of Accipitriformes, such as Neophron percnopterus and marsh harriers were more likely to undertake the water crossing en route to Africa (Agostini et al. 2000, Agostini et al. 2004b, Ceccolini et al. 2009, those species pass over the Central Mediterranean area and the island of Marettimo. On the other hand, short-toed cross the central Mediterranean, preferring to use alternaet al mann et al. 2005). Additional support for the above hypothesis comes from an analysis of the age classes of birds observed in the present study, which were mostly young, inexperienced individuals (Tab. 3). This study shows that at the island of Marettimo it is better do not use the same census method for all species of migrating raptors. Since an accurate count of raptors mi15 Panuccio et al. Table 2. Results of the GLM investigating the relationship between daily count numbers (dependent variable) and weather variables. The Short- toed snake eagle Explanatory Term Estimate S.E. Z value Wind direction Wind speed Temperature 1.0 -0.1 -0.7 -0.07 1.0 -0.1 -0.7 -0.07 1.2 -0.1 -0.3 -0.04 1.2 -0.1 -0.3 -0.04 1.8 -0.02 -0.9 -0.03 1.8 -0.03 -0.9 -0.03 0.7 0.04 0.2 0.04 0.7 0.04 0.2 0.04 0.7 0.05 0.2 0.04 0.7 0.05 0.2 0.03 0.8 0.04 0.3 0.04 0.8 0.04 0.3 0.03 1.41 -2.7 -3.0 -1.8 1.4 -2.8 -3.1 -1.8 1.9 -2.5 -1.2 -1.2 1.8 -2.5 -1.1 -1.2 2.4 -0.6 -3.6 -0.8 2.4 -0.6 -3.6 -0.8 All occurrence Maximum daily count All occurrence Wind direction Wind speed Temperature Wind direction Wind speed Temperature Maximum daily count All occurrence Wind direction Wind speed Temperature Wind direction Wind speed Temperature Maximum daily count Wind direction Wind speed Temperature P (>|z|) <0.01* <0.01* <0.01* <0.01* <0.05* <0.05* <0.05* <0.01* <0.05* <0.01* Table 3. Percentage of adults and juveniles/immatures observed at the site. Species Short-toed snake eagle Lesser spotted eagle Marsh harrier Adult (%) Juveniles/immatures (%) Sample size 4.2 12.5 0 15.1 0 7.1 42 95.8 87.5 100 84.9 100 92.9 58 95 8 6 33 9 28 31 grating through Marettimo is unrealistic, we suggest that broad-winged raptors should be “counted” by considering the maximum number of individuals of the same species observed at the same time on each day. Since recent studibility between different individuals and years (Mellone et al. 2011, Vardanis et al. 2011), we cannot exclude that the the data. For this reason, this method should be seen more 16 as an “activity index rather than an actual estimate of the numbers of individuals passing through et al. 2007) the island of Marettimo, mainly considering that an accurate count is not possible in the case of inexperienced broad-winged raptors approaching a long water crossing. Acknowledgements – This study has been made on behalf of the A comparison of two methods for monitoring migrating broad-winged Raptors We would like to thank MEDRAPTORS (www.raptormigration. org), a network of ornithologists and birdwatchers involved in the research and the protection of migrating birds of prey through spe- REFERENCES Agostini N 2005. Are earlier estimates of Accipitriformes crossing the Channel of Sicily (Central Mediterranean) during spring migration accurate? Journal of Raptor Research 39: 184-186. Buteo buteo migrate across the Channel of Sicily during autumn? Avocetta 29: 19. 2004a. The autumn migration strategies of juvenile and adult Short-toed eagles Circaetus gallicus in the Central Mediterranean. Avocetta 28 (1): 27-40. Agostini N, Coleiro C, Corbi F, Di Lieto G, Pinos F, Panuccio M during migration. Avocetta 26: 41-43. Kites Milvus migrans 10:45–48 timo, important bird area for the autumn migration of raptors. Avocetta 24: 95-99. specie di Accipitriformi migranti, in primavera, sul Mediterone primaverile del Falco pecchiaiolo Pernis apivorus a Cap Agostini N, Panuccio M 2003a. Analysis of the spring migration Pernis apivorus Circus aeruginosus 203-205. nopterus management. Proceedings of the 17th Conference, Chiavenna, 17-22 April 2007, Avocetta 33 (2): 7-12. of Chicago Press, Chicago. Kerlinger P 1985. Water crossing behaviour of raptors during mirspb.2010.2106. low the coast? Flight directions and behaviour of migrating haviour 137: 379-399. falcons and harriers at the southern Mediterranean coast of Spain. Avian Science 3: 153-162. metodi di studio usati nel Mediterraneo centrale. Avocetta 29: 28. Panuccio M 2011. Wind effects on visible raptor migration in Raptor Research 45 (1): 88-92. Circus aeruginosus), sex classes and relation to wind conditions. Vogelwarte, 41: 271-275. Panuccio M, Polini N, Forconi P, Fusari M, Giorgetti G, Marini G, Agostini N 2004. Mount Capodarco: a survey of the migratory behaviour of Accipitriformes along the Adriatic coast of during autumn migration at the Circeo Promontory? Rivista italiana di Ornitologia 73 (2): 165-167. autumn migration of some Accipitriformes over two central Mediterranean islands. Ring 26: 71-78. - tive study over three sites. Avocetta 32: 13-20. Buteo buteo vulpinus techniques. Academic Press, London. Ceccolini G, Cenerini A, Aebischer A 2009. Migration and winNeophron perc- tion: compensation for wind drift in migrating raptors is age dependent. Proceedings Royal Society London (Suppl.) 270: 8-11. ters, doi:10.1098/rsbl.2010.1180. Associate Editor: G. Tellini Florenzano 17 Avocetta 35: 19-22 (2011) Analisi dei fattori di disturbo nelle aree di alimentazione del chiurlo maggiore Numenius arquata in un sito di svernamento dell’Italia centrale MARCO TROTTA Via di Santa Felicola 99, 00134 Roma ([email protected]) Abstract – From 1997-2001, I investigated the effect of disturbance factors on feeding behaviour of the curlew Numenius arquata in a coastal region of Lazio (Pontine Lakes). Recreational activities (mainly mountain biking, birdwatching and hiking) and predators were the main causes of disturbance. Shooting, right beside the protected area where the curlews fed, was also a cause of an escape response. and leaving the feeding sites for other distant areas were also the reactions of birds foraging in areas beside roads when hikers, cyclists or birdwatchers passed close by. To prevent all these disturbance effects on the feeding activity of curlews, good conservation practices bed foraging within a protected area. INTRODUZIONE Il chiurlo maggiore Numenius arquata è una specie migratrice e svernante regolare in Italia (Brichetti e Massa 1998), nel 1996 è stato anche accertato il primo caso 1999). Nel Lazio le concentrazioni maggiori di individui in inverno si osservano nei laghi costieri del Parco Nazionale del Circeo (Biondi et al. 1999, Baccetti et al. 2002). Il chiurlo maggiore è una delle specie che in quest’area ha tratto maggiore giovamento dalla protezione dei laghi e dei pascoli intorno ad essi avvenuta nel 1975. Dai pochi et al. 1993); dopo questo considerevole incremento, l’andamento delle presenze ha mostrato negli anni successivi un aumento di circa il 50% (Corbi, 1996, Trotta, 2001). I pascoli che circondano i laghi pontini, in virtù della loro estensione e del regime di protezione a cui sono soggetti, potrebbero probabilmente ospitare un numero maggiore di individui. In Italia infatti, le aree di alimentazione e di riposo del chiurlo maggiore in inverno sono circoscritte ad ambiti protetti ove la specie non è disturbata dall’attività venatoria (Spagnesi e Serra 2003). Uno dei fattori più ri© 2011 CISO - Centro Italiano Studi Ornitologici levanti che può limitare le presenze in un’area adeguata a soddisfare le esigenze ecologiche di una specie, è il regime di disturbi operante in essa (Meltofte 1986, Smitt e Visser 1993, Perco 2005). In questo lavoro, vengono descritti gli elementi di disturbo a cui sono soggette le aree di alimentazione utilizzate dal chiurlo maggiore durante il periodo invernale. Osservando il comportamento della specie in risposta ai diversi elementi di disturbo, vengono inoltre proposti alcuni interventi per eliminare o mitigare quelli di AREA DI STUDIO E METODI I Laghi Pontini (Fogliano, Monaci, Caprolace e Sabaudia) sono situati all’interno del Parco Nazionale del Circeo in un’area litoranea della provincia di Latina, i quattro bacini costieri sono in comunicazione con il mare attraverso alcuni canali che assicurano il ricambio idrico. Intorno ai laghi, principalmente lungo le sponde occidentali del lago di Fogliano e in quelle meridionali del lago dei Monaci, insistono estesi pascoli caratterizzati da piante erbacee perenni con presenza di varie specie dei generi Juncus, Carex, Cyperus, Scirpus e Salicornia. I pascoli sono destina19 Trotta ti prevalentemente all’allevamento delle bufale allo stato mente piovose, sono soggetti ad allagamenti parziali che si prolungano spesso per alcuni mesi. Nel corso di un’indagine sulle strategie di foraggiamento del chiurlo maggiore in periodo invernale (Trotta 2008), sono stati raccolti dati per quattro anni (1997-2001) sulle cause di disturbo nelle aree di alimentazione. Osservazioni settimanali a parti- 5,3% 15,3% 7,6% 14,5% 3,8% Predatori chiurlo maggiore nell’area in esame. Sulla scorta di queste informazioni sono stati scelti 14 punti di osservazione che hanno consentito di controllare le aree di alimentazione, tutte situate in ambiente di pascolo. I punti sono stati visitati in successione percorrendo settimanalmente in automobile un tragitto di 34 Km., i rilevamenti sono iniziati due ore dopo l’alba e sono terminati due ore prima del tramonto. Il periodo di sosta in ogni punto è stato di 30 minuti, in questo lasso di tempo sono state registrate tutte le mento del chiurlo maggiore in risposta ad esse. Quando a causa del disturbo la specie ha lasciato l’area di foraggiamento e non l’ha rioccupata entro 15 minuti l’azione è stace è tornata in un tempo inferiore ai 15 minuti l’azione è dei dati raccolti, sono riportati i risultati dei conteggi della specie effettuati nel mese di gennaio, dal 1997 al 2006, dell’acqua causate dall’esondazione del lago di Fogliano. L’area, utilizzata come dormitorio dai chiurli che frequentano le zone umide del Parco Nazionale del Circeo, è costituita da un substrato limoso di circa 0,9 ettari diviso dalla duna litoranea da una stretta fascia di giuncheto. RISULTATI Durante i quattro anni d’indagine sono state registrate 131 situazioni di disturbo, oltre la metà sono state causate, in ordine d’importanza relativa, dai predatori e dalle attività del tempo libero (escursionismo, birdwatching e ciclismo fuoristrada) (Fig. 1). Il disturbo provocato indirettamente dall’attività venatoria ha inciso per il 14.5% mentre le avuto una rilevanza minore (meno del 10% in entrambi i casi). La reazione del chiurlo maggiore al disturbo nelle aree di alimentazione si è tradotta in due tipi di azione, pochi minuti. Quando l’origine del disturbo è stata antro- 20 24,4% 29,0% Senza motivo Velivoli ultraleggeri Caccia indiretta Figura 1. Percentuale di casi in cui ciascuna fonte di disturbo ha causato l’allontanamento dei chiurli in alimentazione – Percentage of cases in which each source of disturbance caused the desertion of the feeding areas by curlews. foraggiamento nel 79.4% dei casi, quando invece le cause che) la percentuale di abbandono è stata decisamente infe2 = 21.98; df = 1, correzione di Yates, P < 0.01). La minaccia più frequente portata dai predatori è rappresentata dal falco di palude Circus aeruginosus, raro il disturbo arrecato dal falco pellegrino Falco peregrinus, trascurabile quello dell’albanella reale Circus cyaneus. DISCUSSIONE I rapaci rappresentano uno dei principali pericoli per i limicoli presenti in inverno lungo le fasce costiere (Buchanan et al. et al. 2008). Nelle zone umide del Parco Nazionale del Circeo il falco di palude è il rapace più abbondante durante il periodo invernale, nella stagione 1997-98 sono stati vato un solo attacco diretto al chiurlo maggiore, il volo in caccia dei falchi di palude costringe la specie ad assumere una posizione di allerta e in alcuni casi a lasciare il sito di foraggiamento; nel 76.3% dei casi l’area è stata comunque rioccupata dopo il passaggio del rapace (Tab. 1). Il disturbo arrecato dalle attività del tempo libero è stato elevato, sia per il numero di situazioni osservate, sia per la risposta del chiurlo maggiore ad esse, la specie ha infatti rioccupato l’area solo nel 28.1% dei casi. Particolarmente grave la ciente i pascoli che costeggiano il lago di Fogliano, dove la Analisi dei fattori di disturbo nelle aree di alimentazione del Chiurlo maggiore Tabella 1. Percentuale di casi di abbandono e rioccupazione delle aree di alimentazione per ogni fonte di disturbo – Percentage of reoccupation and desertion cases in the feeding areas due to different sources of disturbance. Cause di disturbo Predatori Velivoli ultraleggeri Caccia indiretta Senza motivo rioccupazione (%) abbandono (%) eventi di disturbo (n) 28,1 76,3 0,0 10,5 20,0 85,0 85,0 71,9 23,7 100,0 89,5 80,0 15,0 15,0 32 38 5 19 10 20 7 sosta di persone, ciclisti e birdwatcher, costringe il chiurlo maggiore ad alimentarsi a distanze elevate dalla strada sfruttando così solo parzialmente l’area di foraggiamento. Sebbene non sia tra le principali cause di disturbo anche la caccia, per quanto in modo indiretto, ha un impatto negativo sulla specie. Il rumore degli spari che provengono dalle infatti, causare l’abbandono del sito di alimentazione, che è stato rioccupato solo nel 10.5% dei casi. Inoltre, per gli individui che si alimentano fuori dall’area protetta, l’attività venatoria condiziona anche il rientro al dormitorio obbligando la specie a percorrere distanze più lunghe con un maggiore dispendio energetico (Trotta 2002). In uno studio sul ruolo della caccia nel declino delle popolazioni fenno-scandinave del chiurlo maggiore, Meltofte (1986) ipotizza che l’aumento della distanza tra il roost e le aree di alimentazione possa indurre la specie ad abbandonare i riconducibili ad azioni di allontanamento di un individuo dalla sua zona di foraggiamento e occupazione della stessa area da parte dell’invasore (area-copying), pur essendo poco frequenti, hanno determinato in molti casi l’abbandono te inoltre numerose situazioni in cui il chiurlo maggiore si è allontanato senza alcun motivo apparente (15.3%). Questo comportamento, registrato sempre quando la specie si alimentava in gruppo, è stato osservato anche nel Wadden Sea negli stormi di piovanello maggiore Calidris canutus che durante la giornata erano stati sottoposti a situazioni prolungate di disturbo (Koolhaas et al. 1992). Nell’85.0% dei casi, i chiurli sono tornati dopo ampi voli circolari ad occupare la zona di foraggiamento. Sebbene sia poco frequente, il passaggio di aerei ultraleggeri e deltaplani a moscana e in diverse zone umide europee, il sorvolo a bassa quota e l’andatura lenta di questi velivoli generano un elevato grado di allarme negli uccelli (Scoccianti e Tinarel- li 1999, Robinson e Pollitt 2002, Komenda-Zehnder et al. 2003). Nel Wadden Sea gli aerei ultraleggeri sono considerati la fonte di disturbo più grande (Smitt e Visser 1993). Dopo il consistente aumento avvenuto nei venti anni successivi alla protezione (1975) dei laghi Pontini e dei pascoli intorno ad essi, il confronto delle presenze nei due quinquenni 1997-2001 e 2002-2006 mostra una sostanziale stabilità (Tab. 2). I dati a disposizione non sono comunque nelle aree di alimentazione e l’andamento delle presenze distanza di circa dieci anni dai dati raccolti nella presente indagine, il grado di disturbo a cui sono soggette le aree di alimentazione è rimasto pressoché invariato; estremamente critica è invece la situazione che si registra presso il roost, dove il sorvolo a bassa quota dei velivoli ultraleggeri costringe i chiurli ad abbandonare il dormitorio in attesa del cessato pericolo. Prolungate condizioni di disturbo nei siti utilizzati per il riposo notturno possono determinare un fetti negativi sulla sopravvivenza degli stessi (Durell et al. poste alcune azioni per mitigare gli elementi di minaccia emersi in questo studio, come per esempio vietare il sorvolo dei velivoli sulle aree più sensibili all’interno del Parco, garantire delle zone cuscinetto interdette alla caccia lunnei siti più esposti alle fonti di disturbo acustico e visivo. Tabella 2. Confronto tra due quinquenni dei censimenti del chiurlo maggiore nei laghi pontini con conteggi effettuati al roost nel mese di gennaio (1997-2006) – Comparison between the two quinquennial periods of the roost counts of curlew in the Pontini Lakes in January. Quinquennio 1997-2001 2002-2006 Min / Max media 127-152 120-139 138 130 21 Trotta Il chiurlo maggiore è particolarmente sensibile al disturbo antropico e reagisce con una distanza di fuga maggiore rispetto ad altri limicoli (Smitt e Visser 1993). Diventa quindi fondamentale la realizzazione di barriere vegetali in quei tratti stradali prospicienti le aree di alimentazione che, soprattutto durante il week-end, sono utilizzati da un numero notevole di persone come sosta o punto di ristoro. no a poca distanza dalla carreggiata senza essere disturbadi foraggiamento. Ringraziamenti la traduzione in inglese. 162. Dekker D 2003. Peregrine falcon predation on dunlins and ducks and kleptoparasitic interference from bald eagles wintering at Boundary Bay, British Columbia. Journal of Raptor Research 37: 91-97. shorebirds: a case study on the Seine estuary, France. Biological Conservation 123: 67-77. Komenda-Zehnder S, Cevallos M, Bruderer B 2003. Effects of mental approach. Proceedings International Bird Strike Committee, May 2003. Warsaw, Poland. Fenno-Scandian populations of curlews Numenius arquata. Var Fagelv. Suppl. 11: 135-140. - BIBLIOGRAFIA nistero agricoltura e foreste. Collana verde 49: 1-144. Regionale, Udine. datini C, Zenatello M 2002. Risultati dei censimenti degli uccelli acquatici svernanti in Italia: distribuzione, stima e trend delle popolazioni nel 1991-2000. Biologia e Conservazione della Fauna 111: 1-240. turbance to waterbirds in the UK: an analysis of Wetland Bird Survey data, 1995/96 to 1998/99. Bird Study 49: 205211. Scoccianti C, Tinarelli R 1999. Le garzaie in Toscana. Status e prospettive di conservazione. WWF Sezione Regionale To- 1993. I limicoli svernanti nella fascia costiera del Lazio. Rivista Italiana di Ornitologia 63: 86-91. senti in inverno lungo la fascia costiera del Lazio (1992-95). Spagnesi M, Serra L (eds) 2003. Uccelli d’Italia. Quaderni di maggiore, Numenius arquata, in Italia. Rivista Italiana di Ornitologia 69: 45-51. Brichetti P, Massa B 1998. Check-list degli uccelli italiani aggiornata a tutto il 1997. Rivista Italiana di Ornitologia 68: 129152. predation on wintering dunlins: hunting success and dunlin escape tactics. Wilson Bullettin 100: 108-118. Corbi F 1996. I risultati dei censimenti invernali degli uccelli acquatici nei laghi del Parco Nazionale del Circeo (1981-1995). Istituto Nazionale per la Fauna Selvatica, Roma. Trotta M 2001. Lo svernamento dei limicoli nei Laghi Pontini, LaTrotta M 2002. Fenologia della migrazione e svernamento del Chiurlo maggiore Numenius arquata nei Laghi Pontini. Rivista Italiana di Ornitologia 72: 67-75. Trotta M 2008. Strategie di foraggiamento del Chiurlo maggiore Numenius arquata e differenze di successo alimentare tra 32: 41-46. due to predation by large falcons. Ibis 150: 219-230. Associate Editor: G. Fracasso 22 Sulla nomenclatura delle popolazioni urbane di Columba livia J.F. Gmelin, 1789: una revisione critica della letteratura in Italia CORRADO BATTISTI1, MARZIO ZAPPAROLI2 1 2 Abstract many different Italian vernacular names (14) for the feral domesticated populations of rock pigeon (Columba livia J.F. Gmelin, 1789). For ecosystems (e.g., in terms of frequency, density, biomass and impact) the feral domesticated populations of rock pigeon, when occurring, should be added also in local and regional check-lists and atlases. INTRODUZIONE Le popolazioni riconvertite ad una naturale libertà delle razze domestiche di piccione selvatico (Columba livia J.F. Gmelin, 1789) sono state oggetto di numerose ricerche relativamente alla loro origine, posizione tassonomica, ecologia e rapporti con l’uomo. In particolare, quelle presenti in modo regolare, irregolare e sporadico nelle aree antropizzate sono caratterizzate da un alto generalismo ecologico e da una elevata variabilità morfometrica, di colorazione e disegno del mantello e da altrettanta diversità comportamentale (Johnston e Janiga 1995; per l’Italia cfr. Ballarini et al. 1989, Sorace et al. 1997, Baldaccini 1985, 1998, Mercurio et al. 2001). L’origine delle popolazioni urbane di Columba livia è stata ampiamente discussa da Johnston e Janiga (1995), secondo i quali esse sono costituite da individui di provenienza domestica sfuggiti alla cattività e divenuti randagi; per quanto riguarda l’Italia si rimanda a Baldaccini e Giunchi (2006) e alla letteratura ivi citata. Popolazioni costituite da individui di provenienza domestica di Columba livia sono attualmente presenti in gran parte delle città europee, ove questa specie può rientrare tra i taxa dominanti nelle ornitocenosi in termini di densità e biomassa (Johnston e Janiga 1995, Kelcey e Rheinwald 2005), con ricadute anche per impatto sociale, potenziali © 2011 CISO - Centro Italiano Studi Ornitologici rischi sanitari e danni all’agricoltura (Dinetti e Gallo-Orsi 1998, Baldaccini e Giunchi 2007, AAVV 2011, Albonetti et al. 2011a,b, Baldaccini et al. 2011). La grande diffusione degli individui di provenienza domestica può inoltre rappresentare una minaccia per le popolazioni selvatiche a causa della elevata interfecondità con i primi, che può portare alla scomparsa di queste ultime (Baldaccini 1993, Johnston et al. 1998, LIPU e WWF 1999). selvatico è complessa e controversa e, a quanto pare, solo si: Gmelin (1789: 769) utilizzò l’epiteto livia per nominare una varietà di C. domestica, taxon precedentemente istituito da Linneo (1758: 162, 1766: 279) per una varietà di C. oenas (1789: 769). Bonnaterre (1790) eleva C. d. livia a rango di specie e “C. livia Bonnaterre” verrà in seguito utilizzato per indicare il piccione selvatico da gran parte degli Autori del XIX secolo, anche se il naturalista francese Pierre Joseph Bonnaterre (1752-1804) non è in ogni caso l’autore di livia. Steinejer (1887) ritiene che il nome corretto per il piccione selvatico non sia C. livia ma C. domestica e questa interpretazione viene confermata da Oberholser (1974: 983) che considera livia sinonimo di domestica. Recentemente Banks e Browing (1995: 635) hanno rigettato l’interpretazione di Steinejer (1887) e di Oberholser (1974) in 23 Battisti e Zapparoli quanto Linneo (1758, 1766) avrebbe fondato C. domestica in base a fonti riferibili sia a C. livia, sia a C. oenas. Sempre secondo Banks e Browing (1995: 635) i riferimenti riportati da Gmelin (1789) come base per domestica riguardano anch’essi più di una specie, mentre quelli che lo stesso Autore riporta per livia si riferiscono ad un’unica entità tassonomica, corrispondente al piccione selvatico, e considerano perciò Columba livia Gmelin, 1789 il nome corretto da applicare a questa specie. Allo stato attuale, la cosiddetta “forma domestica” (sensu Baldaccini 1984, 1985, Ballarini et al. 1989) non è inserita nei repertori dei nomi volgari degli uccelli italiani (Massa et al. 1993, Violani e Barbagli 2006), pur se essa è considerata da alcuni autori come un taxon, seppur atipico, appartenente alle faune locali (cfr. R. Massa in Vigorita e Cucé 2008; ma vedi Baldaccini 1998). Tuttavia, quando riportato, il nome italiano di questa forma risulta estremamente variabile e, per quanto riguarda la nomenclatura miche” non sempre corrette sul piano formale. Va inoltre aggiunto che anche nel campo della giurisprudenza (es. ricorsi al TAR da parte delle associazioni animaliste e ambientaliste) la terminologia è molto “variegata” e ciò complica ulteriormente un quadro gestionale per vari versi dif- RISULTATI Malgrado forme domestiche sfuggite alla cattività siano state menzionate in alcune check-list (es., tortora domestica, Streptopelia “risoria” in Brunelli e Fraticelli 2004), il taxon al quale sono riferite le popolazioni randagie di piccione selvatico di origine domestica è stato inserito solo raramente in alcuni atlanti e check-list regionali e locali (es., Cignini e Zapparoli 1996, Pavia e Boano 2009), mentre non è stato riportato in altri analoghi studi a scala differente, benché il taxon fosse certamente presente nell’area oggetto d’indagine (es., Brichetti e Massa 1998, Brunelli e Fraticelli 2004, Fracasso et al. 2009, Brunelli et al. 2011). Quando riportato, tale taxon è indicato con una molteplicità di sinonimi nel nome italiano e differenti formulazioni della letteratura, nei circa 80 lavori in cui il taxon è citato sono emersi 14 sinonimi del nome in italiano e quatColumba livia, Columba livia forma domestica, Columba livia var. domestica, Columba livia domestica), per complessive 25 com(Tab. 1). DISCUSSIONE Visto il ruolo che questa specie mostra in termini di frequenza, densità, biomassa, impatto e relazioni ecologiche negli ambienti antropizzati, nonché la sua importanza dal punto di vista socio-economico e igienico-sanitario, riteniamo che sia necessario uniformare tale nomenclatura. Pertanto, scopo di questo lavoro è stato quello di analizzare i diversi nomi in italiano e le combinazioni “tassonomiche” utilizzate per indicare le popolazioni randagie di origine domestica del piccione selvatico, proponendo un’unica terminologia di riferimento. METODI Per la stesura di questa nota è stato consultato un campione portanza nazionale e regionale (Avocetta, Rivista italiana di Ornitologia, Alula, Picus, Gli Uccelli d’Italia), oltre ad Atti di Convegni di Ornitologia nazionali e locali, Atlanti ornitologici regionali, provinciali, comunali e urbani, pubblicati dal 1983 al 2011, unitamente ad alcune fonti storiche (Giglioli 1886, Arrigoni degli Oddi 1902, 1929, Moltoni 1946). Ove era citata la “forma domestica” del piccione selvatico, sono stati annotati il nome italiano e il nome 24 L’uso di numerosi sinonimi nel nome italiano assegnato alle popolazioni randagie di origine domestica del piccione selvatico rispecchia quanto avviene anche in altri Paesi (es., nel mondo anglosassone: feral pigeon, urban pigeon, street pigeon, city pigeon, cfr. Johnston e Janiga 1995). Per le popolazioni di Columba livia che vivono allo stato selvatico, ossia in modo non dipendente dall’uomo per alimentazione, riproduzione e habitat, nella lingua italiana è casso et al. 2009). Di tale termine si trova ampio riscontro sia nella letteratura storica (es. Giglioli 1886, Arrigoni degli Oddi 1904, 1929, Moltoni 1946), sia in quella contemporanea (es. Meschini e Frugis 1993, Violani e Barbagli 2006). Consideriamo sinonimo di “piccione selvatico” il termine “piccione torraiolo”, utilizzato per indicare popolazioni inurbate di piccione selvatico (Ghigi 1950), situazione attualmente ritenuta rara (Baldaccini 1998, Dinetti la nomenclatura in italiano, si suggerisce di evitare l’utilizzo di questo termine per indicare popolazioni di aree urbane e suburbane, anche nel caso in cui si sia certi della loro origine selvatica, preferendo a questo il termine “piccione selvatico”. Sulla nomenclatura delle popolazioni urbane di Columba livia Tabella 1 origine domestica (periodo 1983-2011: circa 80 lavori); - = nome non indicato. fonti nome volgare Piccione Piccione domestico Columba livia rinselvatichite di Columba livia var. domestica Nappi 2001 Columba livia Sorace et al. 1997, Dell’Ariccia et al. 2005, Lorenzetti e Taffon 2007 Columba livia forma domestica Visentini Paiotta e Osella 1985 Fraissinet e Milone 1985, Salvo 1991, Ranazzi e De Giacomo 2005, Columba livia et al. 2008, Sighele et al. 2009 Piccione urbano Piccione torraiolo - Savo 1995 Columba livia var. domestica Sarrocco et al. 2002 Columba livia forma domestica Bottino et al. 1998, Ukmar et al. 2007 Columba livia forma domestica Fraticelli 2005, 2008, 2010 Columba livia Dell’Ariccia et al. 2005 - Savo 1995 Columba livia Vigorita e Cucé 2008 Columba livia var. domestica Cairo e Facoetti 2006 Piccione selvatico forma domestica Columba livia forma domestica LIPU e WWF 1999, Demartini e Polinori 2001, Guidi e Battisti 2010 Stival 2008 Columba livia Piccione selvatico var. torraiola Piccione selvatico Piccione di città Columba livia forma domestica Sorace et al. 2004, Corsetti 2008 Martignoni 1992 Columba livia Columba livia forma domestica Groppali 1990, 1994, Dinetti 1994, Falcinelli 2005, Troccoli 2005, Dinetti e Ascani 2009 Colombo Columba livia var. domestica Cignini e Zapparoli 1996, Giovacchini 2001, Brichetti e Fracasso 2003 Columba livia var. domestica Fraissinet 1995 Columba livia forma domestica Baldaccini e Mongini 1985, Baldaccini 1998, Ferraresi et al. 1998, Fusco e Milone 1998, Troccoli 2005 - Ballarini et al. 1989, Ragionieri et al. urbane), Baldaccini 1993 (specif. “di provenienza urbana e domestica”), Baldaccini et al. 1994, Francia et al. 2005, Fraissinet e Dinetti 2009, Baldaccini in Meschini e Frugis 1993 (specif. di provenienza urbana e domestica) Colombo urbano Columba livia forma domestica Barbieri e De Andreis 1991 Baldaccini e Mongini 1991, Baldaccini et al. 1994 - Colombo di città Columba livia forma domestica Baldaccini e Giunchi 2007 Maffei et al. 2001 Columba livia domestica Colombo “urbanizzato” Columba livia forma domestica Baldaccini 1984, 1985, Dinetti e Ascani 1987, Cavalletti e Giardini 1997, Bernini et al. 1998, Dinetti e Gallo-Orsi 1998, Dinetti 2001, 2002, Dinetti e Fraissinet 2001, Maffei et al. 2001, Dinetti e Romano 2002, Nardo 2003, Nova 2003, Fraissinet 2006, Parodi 2008, AA. VV. 2011 Columba livia var. domestica Borgo et al. 2005, Cairo e Facoetti 2006, Demartini et al. 2006, Dinetti 2009 Columba livia Ranazzi e De Giacomo 2005 - Baldaccini e Mongini 1991, Capitani et al. 2007 Colombo torraiolo - Cerruti Sola 1988 Colombo domestico Columba livia domestica Mostini 2004, 2007 - Columba livia domestica Taffon e Battisti 2003 Columba livia forma domestica Pavia e Boano 2009, Albonetti et al. 2011a, 2011b Cignini et al. 1994, Fraissinet 2000, Guglielmi et al. 2001 (rif. a Columba livia piccioni in ambiente urbano), Mencarelli et al. 2009 Columba livia var. domestica Galli e Spanò 2001, Fraissinet 2005 25 Battisti e Zapparoli Per gli individui che vivono in cattività o in semi-cattività, che quindi sono controllati dall’uomo per quanto riguarda alimentazione e riproduzione e non costituiscono perciò popolazioni randagie, adottiamo il nome di “piccione domestico”, contrapponibile a “piccione selvatico”. Consideriamo sinonimo di “piccione domestico” il termine “colombo domestico”. Si ricorda inoltre che il fondamentale testo di Levi (1941) sull’allevamento di C. livia, ha per titolo “The Pigeon”. Per le popolazioni sinantrope, cioè costituite da individui di provenienza domestica multipla, un tempo allevati dall’uomo per scopi diversi ma attualmente più o meno indipendenti da esso per alimentazione, riproduzione e uso dell’habitat, che vivono allo stato libero, prevalentemente nelle aree antropizzate ma con spostamenti e frequentazione più o meno assidua anche delle aree agricole circostanti, suggeriamo di utilizzare il termine “piccione di città”. Tale scelta è motivata dal fatto che, sebbene il termine “colombo di città” compaia più frequentemente di “piccione di città” nella letteratura recente (cfr. Tab. 1), quest’ultimo, oltre ad essere anch’esso molto utilizzato, ben si contrappone a quello di “piccione selvatico” ed è in accordo con i criteri utilizzati dalla Commissione Ornitologica Italiana nella recente revisione dei nomi volgari degli uccelli della fauna italiana (Fracasso et al. 2009), secondo cui è stato aggiunto un aggettivo a tutte le specie in cui vi è rischio di che il primo contributo moderno sulle popolazioni sinantrope di Columba livia in Italia ha per titolo proprio “I Piccioni in città” (AAVV 1984). Consideriamo sinonimi di “piccione di città”, i termini “colombo di città”, “colombo urbano”, “piccione urbano”. Indipendentemente dal nome in italiano assegnato, nei ste popolazioni in Italia si osserva una certa eterogeneità fatti, da diversi anni è consuetudine accompagnare il binomio Columba livia, con il connettivo “forma” seguito dall’epiteto “domestica”, scritto in corsivo. Tale terminologia è stata per la prima volta suggerita da Baldaccini (1984) e ad essa si è uniformata la maggior parte degli Autori successivi. Talvolta, al posto di “forma” è utilizzata l’abbreviazione “f.” o il termine “varietà”, anche con le abbreviazioni “v.” o “var.”; talvolta il connettivo è omesso, ottenendo così Columba livia domestica, o l’epiteto è riportato in parentesi, cioè Columba livia (forma domestica). Nei pochi casi in cui è citato l’Autore questo avviene, Columba livia forma domestica J.F. Gmelin, 1789; Columba livia forma domestica J.F. Gmelin, 1789). L’uso dell’epiteto “domestica” dopo Columba livia 26 ha le sue basi nella nomenclatura che convenzionalmente è adottata per le forme domestiche di altre specie di vertebrati (vedi ad es. Bohlken 1958, 1961, Clutton-Brock 1999) e nasce dall’esigenza di fornire una chiara indicazione sull’origine delle popolazioni nell’eventuale necessità di dover adottare misure di controllo (Baldaccini 1984, 1985). Va tuttavia sottolineato che, dal punto di vista della sion on Zoological Nomenclature 1999), tale epiteto non ha alcuna validità, in quanto inteso con valore di “forma” o “varietà”. Inoltre, se non esplicitamente preceduto dal connettivo “forma” o “varietà”, il termine “domestica” potrebbe proprio apparire come l’epiteto che denota un taxon costituite da individui randagi, non ha alcun senso biologico o evolutivo e quindi tassonomico, oltre a non essere coerente con la storia della nomenclatura di Columba livia, come sopra riportato. Pertanto, per una sua coerente e non re corsivo e di utilizzare quindi per il piccione di città l’espressione: Columba livia J.F. Gmelin, 1789 forma domestica. Tale convenzione dovrebbe essere adottata anche per le varietà domestiche in senso stretto. L’inserimento del piccione di città in check-list e cataloghi può essere utile ma andrebbe regolamentato. Visto il ruolo che esso ricopre nello strutturare le comunità ornitiche di molti ambienti antropizzati (per densità, biomassa, peso ecologico, impatto e relazioni dirette o indiet al. 2008, Sorace e Gustin 2008), e che l’attuale orientamento in giurisprudenza, a seguito della sentenza del 26 gennaio 2004 n. 2598 della Corte di Cassazione sezione Penale III, è quello di equiparare il piccione di città a specie selvatica, proponiamo che, se presente, esso sia sempre incluso nelle check-list e negli atlanti locali e regionali (come già attuato da Pavia e Boano 2009) con il codice C - Intr delle categorie AERC TAC (2003), ovvero taxon introdotto dall’uomo o sfuggito a cattività, che ha formato almeno una popola- Ringraziamenti – Ringraziamo Natale E. Baldaccini, Massimo Brunelli, Marco Dinetti, Fulvio Fraticelli, Alessandro Minelli, Alberto Sorace per la rilettura critica di una precedente versione del testo e i suggerimenti forniti. BIBLIOGRAFIA AAVV 1984. Giornata di studio “I Piccioni in città”. Comune di Siena, Siena, 114 pp. AAVV 2010. Speciale Colombi in città. Manuale pratico di gestione. Ecologia Urbana 22 (1): 3-34. Sulla nomenclatura delle popolazioni urbane di Columba livia AERC TAC 2003. AERC TAC Checklist of bird taxa occurring in Western Palearctic Region, with distributional notes on subspecies. 15th Draft on line: http://www.aerc.be Albonetti P, Repetto L, Ferretti S, Chiaranz G, Orecchia S 2011a. Development of infertility agent for managing rock pigeons (Columba livia forma domestica) populations in Genoa: methods and statistic techniques. In: Angelici FM, Petrozzi F (eds), Abstracts of II International Congress “Problematic Wildlife, Conservation and Management”, Genazzano, p. 68. Albonetti P, Repetto L, Sasso E, Ferretti S, Chiaranz G, Orecchia S 2011b. Development of infertility agent for managing rock pigeons (Columba livia forma domestica) populations in Genoa: long term studies on local population. In: Angelici FM, Petrozzi F (eds), Abstracts of II International Congress “Problematic Wildlife, Conservation and Management”, Genazzano, p. 75. Arrigoni degli Oddi E 1902. Atlante ornitologico. Uccelli europei con notizie d’indole generale e particolare. U. Hoepli, Milano [ristampa anastatica del 1985]. Arrigoni degli Oddi E 1929. Ornitologia italiana. Hoepli, Milano. Baldaccini NE 1984. Considerazioni biologiche e comportamentali sul colombo di città. In: Giornata di studio “I Piccioni in città”. Comune di Siena, Siena, pp. 9-19. Baldaccini NE 1985. Il colombo di città è un’entità domestica o selvatica? In: Fasola M (ed), Atti III Convegno Italiano di Ornitologia, Pavia, pp. 217-218. Baldaccini NE 1993. Piccione selvatico Columba livia. In: MeItalia. Supplemento alle Ricerche di Biologia della Selvaggina 20: 137. Baldaccini NE 1998. Il controllo dei colombi nelle città. In: Bologna MA, Carpaneto GM, Cignini B (eds), Atti del I Convegno Nazionale sulla Fauna Urbana, Fratelli Palombi Editori, pp. 47-50. Baldaccini NE, Giunchi D 2006. Le popolazioni urbane di colombo: considerazioni sulla loro genesi e sulle metodologie di gestione. Biologia Ambientale 20: 125-141. Baldaccini NE, Giunchi D 2007. Effetti simulati del controllo di popolazioni di Colombo urbano Columba livia forma domestica. In: Angelici FM, Petrozzi F, Galli A (eds), Atti del Convegno Internazionale “Fauna problematica: conservazione e gestione”, pp. 70-71. Baldaccini NE, Giunchi D, Mazzarone V, Vanni L, Vecchio G 2011. Monitoring and managing urban pigeons in relation to crop protection: the case of Pisa’s district. In: Angelici FM, Petrozzi F (eds), Abstracts of II International Congress “Problematic Wildlife, Conservation and Management”, Genazzano, p. 16. Baldaccini NE, Mongini E 1985. Censimento dei colombi (Columba livia forma domestica) della città di La Spezia e loro tentativo di controllo. In: Fasola M (ed), Atti III Convegno Italiano di Ornitologia, Pavia, pp. 223-224. Baldaccini NE, Mongini E 1991. Diminuzione del numero di colombi di città a Bolzano in seguito a interventi di controllo. Atti V Convegno Italiano di Ornitologia. Supplemento alle Ricerche di Biologia della Selvaggina 27: 215-217. Baldaccini NE, Mongini E, Ragionieri L 1994. Entità degli spostamenti giornalieri in colombi selvatici e urbani. Atti del VI Convegno Italiano di Ornitologia. Museo Regionale di Scienze Naturali, Torino, pp. 443-444. Ballarini G 1985. Controllo delle popolazioni urbane di colombi. In: Fasola M (ed), Atti III Convegno Italiano di Ornitologia, Pavia, pp. 211-215. Ballarini G, Baldaccini NE, Pezza F 1989. Colombi in città. Documenti Tecnici Istituto Nazionale Biologia Selvaggina, 6. Banks RC, Browning MR 1995. Comments on the status of revived old names for some North American birds. Auk 112: 633-648. Barbieri F, De Andreis C 1991. Indagine sulla presenza dei Colombi (Columba livia forma domestica) nel centro storico di Pavia e nell’Oltrepò Pavese (U.S.L. n. 79, Voghera). Atti V Convegno Italiano di Ornitologia. Supplemento alle Ricerche di Biologia della Selvaggina 27: 195-198. Bernini F, Dinetti M, Gariboldi A, Matessi G, Rognoni G 1998. PU. Bohlken H 1958. Zur Nomenklatur der Haustiere. Zoologischer Anzeiger 160: 167-168. Bohlken H 1961. Haustiere und zoologische Systematik. Zeitschrift für Tierzüchtung und Züchtungsbiologie 76: 107-113. Bonnaterre P. J. 1790. Tableau encyclopédique et méthodique des trois règnes de la nature. Ornithologie. Panckoucke, Paris. Borgo E, Galli L, Galuppo C, Maranini N, Spanò S 2005. Atlante ornitologico della città di Genova (1996-2000). Bollettino dei Musei e degli Istituti Biologici dell’Università di Genova 69-70: 5-317. Bottino S, Spanò S, Borgo E, Albonetti P 1998. La popolazione urbana di Piccione domestico (Columba livia forma domestica) a Genova: dati preliminari. In: Bologna MA, Carpaneto GM, Cignini B (eds), Atti del I Convegno Nazionale sulla Fauna Urbana, Fratelli Palombi Editori, pp. 185-188. Brichetti P, Fracasso G 2003. Ornitologia italiana. Vol. 1. Gaviidae-Falconidae. Alberto Perdisa Editore, Bologna. Brichetti P, Massa B 1998. Check-list degli uccelli italiani aggiornata a tutto il 1997. Rivista italiana di Ornitologia 68: 129152. Brunelli M, Fraticelli F 2004. Check-list degli uccelli del Lazio: specie escluse a tutto il 2002. Alula 11: 86-92. Brunelli M, Sarrocco S, Corbi F, Sorace A, Boano A, De Felici S, Guerrieri G, Meschini A, Roma S 2011. Nuovo Atlante deCairo E, Facoetti R (eds) 2006. Atlante degli uccelli di Bergamo. Capitani F, Dinetti M, Fangarezzi C, Piani C, Selmi E 2007. Barriere fonoassorbenti trasparenti: impatto sull’avifauna nella periferia della città di Modena. Rivista italiana di Ornitologia 76: 115-124. bo di città, Columba livia forma domestica. Rivista italiana di Ornitologia 67: 195. Cerruti Sola S 1988. La chemiosterilizzazione come mezzo di controllo della riproduzione del colombo torraiolo. Nuovo Progresso Veterinario 43: 628-632. Cignini B, Meschini A, Zapparoli M 1994. Progetto Atlante degli Atti del VI Convegno Italiano di Ornitologia. Museo Regionale di Scienze Naturali, Torino, pp. 533-534. ti a Roma. Fratelli Palombi Editore, Roma. Clutton-Brock J 1999. A natural history of domesticated mammals. Cambridge University Press, Cambridge. Corsetti L 2008. Gli uccelli del Parco Naturale dei Monti Aurunci (Lazio meridionale): preferenze ambientali e priorità di conservazione. Alula 15: 153-164. Dell’Ariccia G, Lipp H-P, Dell’Omo G 2005. Spostamenti dei piccioni romani: uno studio preliminare con il GPS. Alula 12: 97-102. Dell’Omo A, Morabito S, Agrimi U, Dell’Omo G 2001. Sex recognition in feral pigeons. Atti XI Convegno Italiano di Ornitologia. Avocetta 25: 200. Demartini L, Polinori A 2001. L’avifauna di una zona umida ardi Ostia a due anni dall’inizio dello scavo. Gli Uccelli d’Italia 26: 87-100. Demartini L, Sorace A, Cecere JG, Savo E, Polinori A 2006. 27 Battisti e Zapparoli Ostia. Regione Lazio, LIPU, CHM, Roma. di Firenze: terza edizione 2007-2008. LIPU, Parma. Comune Notizie (suppl.), 10: 1-172. Dinetti M 2001. Ricerche e attività di gestione del Colombo di città. Atti XI Convegno Italiano di Ornitologia. Avocetta 25: 135. Dinetti M 2002. Ornitologia urbana: ricerche e applicazioni delle conoscenze. In: Ecosistemi urbani, Convegno nell’ambito della Conferenza annuale della Ricerca. Atti dei Convegni Lincei 182: 191-199. canti nel Comune di Firenze: risultati preliminari. Avocetta 11: 71-72. mune di Firenze. Assessorato all’Ambiente, Firenze. Dinetti M, Fraissinet M 2001. Ornitologia urbana. Calderini Edagricole, Bologna. Dinetti M, Gallo-Orsi U 1998. Colombi e storni in città: manuale pratico di gestione. Il Verde Editorale, Milano. Comune di Firenze (1997-1998). LIPU, Comune di Firenze. Falcinelli M 2005. Ptilocronologia in una popolazione di piccione di città Columba livia forma domestica. Alula 12: 141-147. Ferraresi M, Gelati A, Ferri M, Zannetti G 1998. Effetti della nicarbazina sull’attività riproduttiva del Colombo: nota preliminare su esperienze di campo. In: Bologna MA, Carpaneto GM, Cignini B (eds), Atti del I Convegno Nazionale sulla Fauna Urbana, Fratelli Palombi Editori, pp. 189-192. Fracasso G, Baccetti N, Serra L 2009. La lista CISO-COI degli Uccelli italiani - Parte prima: liste A, B e C. Avocetta 33: 5-24. nella città di Napoli. ASOIM, Asociazione Studi Ornitologici Fraissinet M 2000. Elementi di analisi dell’avifauna italiana nidi13-27. e svernanti nella città di Napoli (2001-2005), dati preliminari a una stagione dalla conclusione. Alula 12: 148-154. 7, ASOIM, Napoli. Fraissinet M, Dinetti M 2009. Gli Atlanti ornitologici urbani: uno sguardo d’insieme. In: Brunelli M, Battisti C, Bulgarini F, Cecere J.G Fraticelli F, Gustin M, Sarrocco S, Sorace A (eds), Atti XV Convegno Italiano di Ornitologia. Alula 16: 669-672. Fraissinet M, Milone M 1985. Gli uccelli nella città, bird-watching urbano. Edagricole, Bologna. Francia N, Agrimi U, Alleva E 2005. Popolazioni infestanti di colombi in area urbana e periurbana: considerazioni zooantropologiche e prospettive gestionali. Alula 12: 155-156. Fraticelli F 2001. Inquinamento genetico in una popolazione di piccione selvatico Columba livia. Rivista italiana di Ornitologia 71: 73-75. Fraticelli F 2005. Gli uccelli di Villa Borghese, Roma: effetti della ca. Alula 12: 157-182. Fraticelli F 2008. Cause delle concentrazioni dei piccioni urbani a Roma. Alula 15: 183-187. Fraticelli F 2010. L’utilizzo di un parco pubblico romano da parte del Piccione urbano Columba livia forma domestica. Alula 17: 43-48. Fusco L, Milone M 1998. Successo riproduttivo di Columba livia 28 forma domestica in ambiente urbano in relazione alla struttura del sito. In: Bologna MA, Carpaneto GM, Cignini B (eds), Atti del I Convegno Nazionale sulla Fauna Urbana, Fratelli Palombi Editori, pp. 193-195. Galli L, Spanò S 2001. Avifauna urbana di Savona. Rivista italiana di Ornitologia 71: 145-150. Ghigi A 1950. Piccioni domestici e columbicoltura. R.E.D.A. Roma. Giglioli EH 1886. Avifauna italica. Elenco delle specie di uccelli stazionarie o di passaggio in Italia colla loro sinonimia volgare e con notizie più specialmente intorno alle migrazioni ed Atti Museo Storia naturale della Maremma 17 (suppl.): 1-218. Gmelin JF 1789. Caroli a Linné, Systema naturae. Tom. I. Pars II. Beer, Lipsiae, pp. 501-1032. Groppali R 1990. Fauna urbana in Provincia di Cremona. Editrice Turris, Cremona. Cremona (1990-1993). Azienda Energetica Municipalizzata, Museo Civico di Storia Naturale, Cremona. Guglielmi R, Fraissinet M, Milone M 2001. Successione ecologipoli. Atti XI Convegno Italiano di Ornitologia. Avocetta 25: 164. turale “Monte Catillo” (Tivoli, Italia centrale): check-list e atlante. Alula 17: 59-87. International Commission on Zoological Nomenclature (ICZN) 1999. International code of zoological nomenclature. Fourth edition adopted by the International Union of Biological Sciences. The International Trust for Zoological Nomenclature. Johnston R, Siegel-Causey D, Johnson S 1988. European populations of the rock dove Columba livia and genotypic extinction. The American Midland Naturalist 102: 1-10. Johnston RF, Janiga M 1995. Feral pigeons. Oxford University Press, Oxford. Kelcey JG, Rheinvald G (eds) 2005. Birds in European cities. Ginster Verlag, St. Katharinen. Levi W M 1941. The pigeon. Levi Publishing Co, Columbia, XXXIV + 512 pp. Linné C 1758. Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata. pp. [1-4], 1-824. Salvii, Holmiae. Linné C 1766. Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio duodecima, reformata, pp. 1-532. Salvii, Holmiae. Italia. Rivista italiana di Ornitologia 69: 3-43. Lorenzetti E, Taffon D 2007. Analisi delle comunità ornitiche nili per la conservazione delle aree umide residuali del litorale romano. Provincia di Roma, Assessorato alle Politiche dell’agricoltura e dell’ambiente, Roma, pp. 98-109. Maffei G, Pulcher C, Rolando A, Carisio L 2001. L’avifauna della Museo Regionale di Scienze Naturali, Torino. Martignoni C 1992. Il piccione nella città. Amministrazione Comunale di Mantova, Assessorato Promozione Ambientale, Mantova. Massa R, Bottoni L, Violani C 1993. Lista in lingua italiana degli uccelli di tutto il mondo. Università degli Studi di Milano, Press Color. Crema (CR) nel biennio 2000-2001. Rivista italiana di Ornitologia 72: 261-268. Sulla nomenclatura delle popolazioni urbane di Columba livia Melandri M, Sorace A, Fanfani A, Agrimi U, Dell’Omo G 2001. Differences in feeding behaviour between urban and rural pigeons. Atti XI Convegno Italiano di Ornitologia. Avocetta 25: 228. Mencarelli M, Morganti N, Morici F 2009. Progetto atlante faunistico del Comune di Senigallia: avifauna, primo anno di indagine. In: Brunelli M, Battisti C, Bulgarini F, Cecere JG, Fraticelli F, Gustin M, Sarrocco S, Sorace A (eds), Atti XV Convegno Italiano di Ornitologia. Alula 16: 680-682. Mercurio L, Agrimi U, Fanfani A, Dell’Omo G 2001. Feeding activity and population dynamics of Feral pigeons in Rome. Atti XI Convegno Italiano di Ornitologia. Avocetta 25: 62. in Italia. Supplemento alle Ricerche di Biologia della Selvaggina 20: 1-345. 16: 33-50, 69-162. Mostini L 2004. Predazione di cornacchia grigia Corvus corone cornix su colombo domestico Columba livia domestica. Picus 58: 145. Mostini L 2007. La cornacchia grigia Corvus corone cornix preda abitualmente columbidi urbanizzati. Picus 64: 141. Nappi A 2001. Predazione di gabbiano reale mediterraneo Larus cachinnans su piccione Columba livia var. domestica a Napoli. Atti XI Convegno Ital. di Ornitologia. Avocetta 25: 150. San Donà di Piave. LIPU, San Donà di Piave. Nova M 2003. Da Moltoni al 2000: le conoscenze sugli uccelli 149. Oberholserh C 1974. The bird life of Texas. 2 vols. University of Texas Press, Austin. Parodi R 2008. Avifauna del Comune di Udine. Pubblicazione n. 51. Edizioni del Museo Friulano di Storia Naturale, Comune di Udine. Pavia M, Boano G 2009. Check-list degli uccelli del Piemonte e della Valle d’Aosta aggiornata al dicembre 2008. Rivista italiana di Ornitologia 79: 23-47. Ragionieri L, Mongini E, Baldaccini NE 1991. I colombi della città di Reggio Emilia: censimento, distribuzione, movimenti giornalieri. Alula 1: 45-47. Ranazzi L, De Giacomo U 2005. Il pellegrino Falco peregrinus a Roma: alimentazione e riproduzione di una coppia in ambiente urbano. Alula 12: 206-213. ritorio della Sicilia meridionale. Atti V Convegno Italiano di Ornitologia. Supplemento alle Ricerche di Biologia della Selvaggina 27: 243-245. Sarrocco S, Battisti C, Brunelli M, Calvario E, Ianniello L, Sorace vifauna delle aree naturali protette del comune di Roma gestite dall’Ente Roma Natura. Alula 9: 3-31. Savo E 1995. Piccione selvatico Columba livia. In: Boano A, Brunelli M, Bulgarini F, Montemaggiori A, Sarrocco S, VisenAlula 2: 56-57. bienti antropizzati (Parco dell’Appia antica, Roma): differenze ecologiche e stagionali. Rivista italiana di Ornitologia 78: 37-45. Sighele M, Morbioli M, De Franceschi PF 2009. Check-list dell’avifauna del comune di Verona (dal 1985 al 2009). In: Latella L (ed), Animali in città. Altri abitanti di Verona. Scripta Edizioni, Verona, pp. 183-188. Sorace A, Corsetti L, Lanzuisi E 2004. Le comunità ornitiche svernanti nel comprensorio dei monti Lepini. Alula 11: 119133. Sorace A, Gustin M 2008. Homogenisation processes and local effects on avifaunal composition in Italian towns. Acta Oecologica 33: 15-26. Sorace A, Marini L, Quondam Digiandomenico R, Dell’Omo A, Dell’Omo G, Agrimi U 1997. Biometria del piccione Columba livia nella città di Roma. Avocetta 21: 144. Stejneger L 1887. Review of Japanese birds. VI. The pigeons. Proceedings of the U.S. National Museum 10: 416-429. Stival E 2008. L’avifauna del parco urbano di San Giuliano. Atti V Convegno Faunisti Veneti: 157-161. canti di un settore della provincia di Roma (area MentaneseCornicolana): considerazioni faunistiche, ecologiche, applicative. Alula 10: 3-48. Troccoli C 2005. Composizione fenotipica, patologie e traumi nel Piccione di città Columba livia forma domestica a Roma. Alula 12: 214-228. Ukmar E, Lorenzetti E, Battisti C 2007. Un contributo alla cono(Lazio, Italia centrale). Alula 14: 115-119. Vigorita V, Cucé L 2008. La fauna selvatica in Lombardia. Rapporto 2008 su distribuzione, abbondanza e stato di conservazione di uccelli e mammiferi. Regione Lombardia, Direzione Generale Agricoltura, Milano. Violani C, Barbagli F 2006. Repertorio italiano dei nomi degli uccelli. Parte prima: Struthioniformes - Psittaciformes. Avocetta 30 (n.s.): 5-65. Visentini Paiotta G, Osella BG 1985. La fauna della città di Verona. Museo Civico di Storia Naturale di Verona, Quaderni Naturalistici 1: 1-94. Associate Editor: B. Massa 29 Avocetta 35: 31-39 (2011) Migrazione e svernamento di allodola Alauda arvensis e pispola Anthus pratensis in un ambiente prativo nell’Oltrepò Pavese FLAVIO FERLINI Abstract – Migration and wintering of skylark Alauda arvensis and meadow pipit Anthus pratensis in meadow habitat in Oltrepò Pavese (Lombardy, N Italy). ind./10 ha). Migratory movements of meadow pipit were intense only at the end of November-beginning of December (48.6 ind./10 ha), closer to the margins with tree, while isolated birds totally avoided this situation. Compared with skylark, meadow pipit used areas with greater coverage of soil and grass higher. INTRODUZIONE La contrazione sia numerica che di areale di molte specie anni ‘70 nell’Europa occidentale è stata attribuita alle variazioni intervenute nelle pratiche agricole e, in particolare, et al. 2000, Donald et al. 2001a, Stoate et al. 2001, Newton 2004). Le ricertale declino si sono inizialmente concentrate sulla fase riproduttiva (Potts 1986), successivamente sono però emerse evidenze di effetti sulle popolazioni indotte da variazioni degli habitat di svernamento e quindi della necessità, in ottica conservazionistica, di agire anche su di essi (Evans 1997, Wakeham-Dawson e Aebischer 1998, Peach et al. 1999). In inverno il freddo e la scarsità di cibo possono inli, con conseguenze sulle successive stagioni riproduttive (Thomson et al. 1997, Siriwardena et al. 1998, Henderson et al. 2004). In Gran Bretagna si è rilevato che la riduzioito sulle popolazioni degli uccelli granivori (Wilson et al. 1996, Robinson e Sutherland 1999, Moorcroft et al. 2002) e che le specie insettivore si sono rivelate sensibili all’età e al tipo di concimazione dei prati in quanto da questi fattori dipende la disponibilità di prede durante lo svernamento (Tucker 1992, Wilson et al. 1996, Perkins et al. 2000). © 2011 CISO - Centro Italiano Studi Ornitologici Tra le specie tipiche degli ambienti agricoli, sia l’allodola Alauda arvensis che la pispola Anthus pratensis hanno manifestato negli ultimi decenni segni evidenti di declino nell’Europa occidentale. L’allodola ha subito una forte contrazione numerica già a partire dagli anni 1970 (Busche 1989, Siriwardena et al. 1998, Browne et al. 2000, BirdLife International 2004) e il processo pare tuttora in corso (Gregory et al. 2004, Coordinamento Progetto MITO2000 2006). Per la pispola il fenomeno è stato rilevato solo a partire dall’ultimo decennio del passato millennio e in forma meno accentuata (BirdLife International 2004, Gregory et al. 2004). In inverno le allodole sono quasi esclusivamente granivore/erbivore e in Inghilterra prediligono le aree agricole, ma evitano sia i prati temporanei sia quelli permanenti (Donald et al. 2001b). Anche Wilson et al. (1996), Buckingham et al. (1999) e Gillings e Fuller (2001) hanno osservato che le allodole usano scarsamente le aree erbose durante lo svernamento, mentre Wakeham-Dawson e Aebischer (1998) hanno rilevato che le allodole frequentano i prati “nuovi”, ma tendono ad abbandonarli quando la vegetazione diventa troppo alta. Le specie insettivore come la pispola, invece, preferiscono nettamente i pascoli rispetto ai prati avvicendati e alle stoppie (Tucker 1992, Wilson et al. 1996) in quanto in essi trovano maggiore disponibilità di cibo (principalmente lombrichi e larve d’insetti). Sia gli uccelli granivori che quelli insettivo31 Ferlini ri in genere evitano i campi di cereali in crescita a causa della scarsità sia di invertebrati (Tucker 1992), sia di semi (Roberts e Dawkin 1967). Anche in un ambiente rurale del Piemonte Laiolo (2005) ha rilevato in inverno la preferenza dell’allodola per le stoppie e della pispola per le aree erbose. In Spagna invece in inverno le allodole si concentrano nei pascoli asciutti raggiungendo una densità 10-20 volte superiore a quella rilevabile nelle aree coltivate (Suárez et al. Nella zona pianeggiante dell’Oltrepò Pavese, stante la totale assenza di stoppie e di pascoli, in periodo invernale le due specie frequentano in modo assolutamente marginale i campi di cereali a semina autunnale, mentre utilizzano per il foraggiamento quasi esclusivamente i prati di erba medica Medicago sativa (Ferlini 2006, 2007). Una situazione analoga è stata osservata anche in Italia centrale (Manzi e Perna 1992). Rispetto al totale dei seminativi, i medicai nella Pianura Padana occupano il 10.1% della sunura dell’Oltrepò Pavese (ISTAT 2007). Poiché conoscere i criteri di scelta degli habitat in relazione alla disponibilità di cibo e ad altre variabili è di fondamentale importanza per comprendere i comportamenti delle specie animali, soprattutto per prevedere le conseguenze di variazioni ambientali (Sutherland 1996), scopo di questo studio è di esaminare alcuni aspetti della biologia dell’allodola e della pispola in un ambiente prativo dell’Oltrepò Pavese durante le migrazioni e lo svernamento. METODI Area di studio L’area di studio è collocata nella golena del Po, in destra Bastida Pancarana e in parte in quello di Sommo, in provincia di Pavia (45° 6’ N, 9° 5’ E, 62 m s.l.m.) ed è costituita da un prato di erba medica Medicago sativa esteso tribuiscono alla copertura del suolo; le specie più comuni sono (in ordine decrescente di frequenza): veronica comune Veronica chamaedrys Poa sp., borsapastore Capsella bursa-pastoris, crespino comune Sonchus oleraceus e falsa ortica purpurea Lamium purpureum. In molti ripariale, a nord-ovest con una roggia e a sud-ovest con un campo arato al momento dei rilievi. Su circa il 50% del perimetro del prato è presente una “struttura” verticale, alta 8-9 m costituta dagli alberi ai margini del saliceto (in pre32 valenza Salix sp.), dagli alberi presenti alla base dell’argine (robinie Robinia pseudacacia) e dallo stesso argine. Raccolta ed elaborazione dei dati Dall’ottobre 2007 all’aprile 2008 ho raccolto i dati nell’area di studio effettuando quattro visite in ogni mese (due nella prima metà e due nella seconda metà). Ho eseguito i rilievi, utilizzando un binocolo 10x42, camminando lungo transetti paralleli all’asse minore del campo distanti fra di loro 100 metri e contando solo gli uccelli posati. Dopo alcuni test preliminari, ho preferito la distanza di 100 m tra i transetti rispetto ai 50 m solitamente utilizzati in situazioni analoghe (Perkins et al. 2000, Donald et al. 2001b, Barnett et al. 2004, Whittingham et al. 2006) in quanto, in considerazione dell’erba molto bassa (altezza media = 4 cm, DS = 1.70, range = 1.4-8.6, N = 167), non ho rilevato alcuna sizare il riconteggio degli uccelli seguendone visivamente i movimenti dopo l’involo. Le visite sono iniziate almeno un’ora dopo il sorgere del sole e si sono concluse almeno un’ora prima del tramonto, ciò per evitare di includere uccelli in raggruppamento notturno (Donald et al. 2001b, Whittingham et al. 2006). Ogni rilevazione si è protratta per circa due ore evitando condizioni atmosferiche che potessero incidere sui risultati (pioggia, vento, nebbia). Per ogni contatto ho annotato su una mappa ricavata da fotoQuest’ultimo dato è stato poi utilizzato per esprimere la distanza dei soggetti rispetto ai margini alberati mediante una scala discreta (da 1 a 6) in cui ogni valore equivale a un settore ampio circa 70 m. I valori della scala sono crescenti al crescere della distanza. Nel periodo prettamente invernale (dicembre 2007-febbraio 2008), per ogni occasione in cui sono riuscito ad individuare con precisione le zone di alimentazione di gruppi di almeno 5 individui di ogni specie, ho rilevato le caratteristiche del prato su 5 particelle campione di 0.25 m2 (50 x 50 cm) ricavando i seguenti parametri: altezza della vegetazione, percentuale di copertura del terreno e numero di essenze vegetali presenti pione l’ho ricavata misurando l’altezza dell’erba nei quattro vertici e nel punto centrale del quadrato e calcolandone la media. La percentuale di copertura del terreno l’ho ricavata fotografando il campione ed effettuando successi- RISULTATI Abbondanza e composizione dei gruppi Durante la migrazione autunnale l’abbondanza dell’allo- Migrazione e svernamento di allodola Alauda arvensis e pispola Anthus pratensis dola nell’area di studio è stata elevata rispetto ai successivi do invernale la densità è stata massima all’inizio della stagione (prima metà di dicembre) per poi decrescere a valori estremamente bassi all’inizio di gennaio in concomitanza con una intensa perturbazione nevosa che ha interessato gran parte dell’Italia. Successivamente allo scioglimento del manto nevoso la specie è ricomparsa con densità tuttavia limitate. Tra la seconda metà di febbraio e la prima metà di marzo si è osservato un movimento migratorio preriproduttivo che è stato però di modesta entità (14.8 ind./10 ha). La dimensione dei gruppi è stata massima in autunno per poi decrescere progressivamente dall’inverno (media ra (media = 6.1 ind., DS = 4.68, range = 2-18, N = 17). In inverno i contatti hanno riguardato per il 29.9% allodole gruppi da 6 a 10 individui, per il 9.1% gruppi da 11 a 20 individui e per il restante 11.6% gruppi con più di 20 individui (N = 77). I movimenti migratori della pispola hanno assunto for48.6 ind./10 ha). L’abbondanza della specie è poi calata già dalla seconda metà di dicembre ed è stata scarsa per tutto il restante periodo invernale (Fig. 1). Anche su questo può aver inciso la nevicata della prima metà di gennaio. Durante la migrazione pre-riproduttiva la presenza della specie è stata scarsa, con un modesto picco nella seconda metà di marzo (7.9 ind./10 ha). La dimensione dei gruppi è moderatamente calata dall’autunno (media = 26.5 ind., DS mente diminuita durante la migrazione primaverile (media = 8.7 ind., DS = 8.79, range = 2-27, N = 7). In inverno i 20 individui (N = 27). mento All’inizio dell’inverno le allodole hanno utilizzato intensamente i due settori più prossimi ai margini alberati del campo, mentre successivamente se ne sono progressivamente allontanate (Fig. 2). Le zone più distanti dal saliceto o dall’argine del Po sono state utilizzate principalmente da questi ultimi hanno del tutto evitato le zone più vicine alte, soprattutto in dicembre, dai gruppi numericamente più consistenti (Fig. 4). In ogni caso le aree di foraggiamento diverso rispetto all’ipotesi di equidistribuzione (dicembre: 2 2 = 78.92, P < 0.01, 2 = 126.51, P < 0.01, df = 5). bre a causa dell’esiguo numero di soggetti osservati negli altri mesi invernali. Anche questa specie ha utilizzato fortemente i due settori più prossimi al margine alberato (Fig. 5) nell’ambito dei quali sono avvenuti la maggior parte dei contatti (51.8%). La zona più lontana dagli alberi non è stata utilizzata, mentre, a differenza delle allodole, singole pispole hanno frequentato anche i margini immediatamente prospicienti il saliceto o l’argine del Po (Fig. 6). In dicem- Abbondanza (ind./10 ha) 80 70 60 Allodola 50 Pispola 40 20 10 0 I Ott II Ott I Nov II Nov I Dic II Dic I Gen II Gen I Feb II Feb I Mar II Mar I Apr II Apr Mesi Figura 1. Andamento temporale dell’abbondanza di allodola e pispola (ind./10 ha) – Temporal density trends of skylark and meadow pipit (ind./10 ha). 33 Ferlini 160 140 120 Dicembre 100 Gennaio 80 Febbraio 60 40 20 0 1 2 4 5 6 Distanza da margine alberato Frequenza tipologia di gruppi Figura 2. Distribuzione spaziale invernale delle allodole rispetto al margine alberato – Winter spatial distribution of skylarks in relation to the tree edge. 25 1 20 2-10 15 11-20 10 > 20 5 0 1 2 4 5 6 Distanza da margine alberato Dimensione media dei gruppi Figura 3. Distribuzione di frequenza dei gruppi di allodole in inverno rispetto alla distanza dal margine alberato (N = 77) – Frequency 50 45 40 Dicembre Gennaio 25 20 15 10 5 0 Febbraio 1 2 4 5 6 Distanza da margine alberato Figura 4. Dimensione media mensile dei gruppi di allodole in inverno rispetto alla distanza dal margine alberato – size of skylarks in winter in relation to the distance from tree edge. 34 Migrazione e svernamento di allodola Alauda arvensis e pispola Anthus pratensis 180 160 140 Dicembre 120 Gennaio 100 Febbraio 80 60 40 20 0 1 2 4 5 6 Distanza da margine alberato Frequenza tipologia di gruppi Figura 5. Distribuzione spaziale invernale delle pispole rispetto al margine alberato – Winter spatial distribution of meadow pipits in relation to tree edge. 8 6 1 2-10 4 11-20 > 20 2 0 1 2 4 5 6 Distanza da margine alberato Dimensione media dei gruppi Figura 6. Distribuzione di frequenza dei gruppi di pispole in inverno rispetto alla distanza dal margine alberato (N = 27) – Frequency di- 60 50 Dicembre 40 Gennaio Febbraio 20 10 0 1 2 4 5 6 Distanza da margine alberato Figura 7. Dimensione media mensile dei gruppi di pispole in inverno rispetto alla distanza dal margine alberato – size of meadow pipits in winter in relation to the distance from tree edge. 35 Ferlini Tabella 1. Caratteristiche delle aree prative utilizzate – Characteristics of areas used. Altezza erba (cm) Allodola Pispola Copertura terreno (%) Allodola Pispola Media Range N 4.6 1.4-8.6 1.6-8.6 100 55 67% 76% 5-100% 29-100% 100 55 2-5 2-6 100 55 Allodola Pispola bre le zone prossime alle strutture verticali sono state scelte dai gruppi più numerosi (Fig. 7) e la distribuzione degli 2 Dal confronto fra i parametri che hanno caratterizzato le aree del prato frequentate dalle allodole e dalle pispole durante il periodo invernale (Tab. 1) si rilevano differenle hanno preferito le aree con maggiore presenza di terreutilizzato zone con vegetazione più alta (z = 2.8801, P < 0.01). Non ho rilevato invece alcuna differenza statistica- DISCUSSIONE riodo post-riproduttivo ha avuto andamento simile a quello noto a livello nazionale, infatti l’intensità solitamente è più accentuata da ottobre ad inizio novembre con picco nella e Fracasso 2007). Anche per la migrazione pre-riproduttiva si è registrato un andamento qualitativamente analolo autunnale), ma con il picco anticipato rispetto a quanto indicato in letteratura, tra metà marzo e primi di aprile (Brichetti e Fracasso 2007). Il periodo di massima densità invernale coincide con quello già osservato per l’Oltrepò Pavese nel corso di altre ricerche (de Carli et al. 1998) e ha raggiunto il valore di di abbondanza si è avuto nella seconda metà di dicembre, ma con valori inferiori, pari a circa 14 ind./10 ha (Manzi e Perna 1992). La densità rilevata in questa indagine è simile a quella media rilevata in prati del Portogallo, 29.2 ind./10 ha (Moreira et al. 2005) e superiore a quella degli ambienti similari della Spagna centrale, 20 ind./10 ha (Suárez et al. 2004) e dell’Inghìhlterra, 12 ind./10 ha (Donald et al. 2001b). Sia a livello italiano che europeo sono note densità invernali decisamente superiori, ma in ambienti diversi. In particolare in Piemonte si toccano i 150 ind./10 ha nelle stoppie delle colture cerealicole (Laiolo 2005) e in Spagna 108.1 ind./10 ha nei pascoli asciutti (Suárez et al. 2004). I contatti invernali hanno riguardato per 70.1% soggetti isolati o piccoli gruppi (max 5 individui). Il valore tra area dell’Oltrepò Pavese (Ferlini 2006), ma comparabile a quanto osservato nel corso di altre ricerche sia in Lombardia (75%, Fornasari et al. 1992) che nel Veneto (79%, Nardo e Stival 1996). mile a quelli massimi osservati in Lombardia (160 individui, Fornasari et al. Nardo e Stival 1996). Anche per la pispola il massimo della densità invernale (48.6 ind./10 ha) si è avuto nella prima metà di dicembre. Nei medicai di un’altra area dell’Oltrepò Pavese nel corso dell’inverno 2004/2005 avevo rilevato la densità massima Entrambi i valori sono superiori a quelli noti per gli ambienti prativi di altre aree dell’Europa meridionale quali la Spagna centrale (max 2 ind./10 ha, Suárez et al. 2004) e il Portogallo (media 10.4 ind./10 ha, Moreira et al. 2005). L’andamento temporale della presenza della specie con rispetto a quanto osservato a livello nazionale sia rispetto a gratorio post-riproduttivo della pispola si manifesta tra metà settembre e novembre, con massimo tra ottobre e metà novembre e picco nella seconda metà d’ottobre (Brichetti e Fracasso 2007). In Lombardia la massima abbondanza et al. 1992); per la provincia di Brescia sono però noti stormi di maverili sono invece coincidenti con quelli normalmente metà marzo e metà aprile (Brichetti e Fracasso 2007). di un’altra area dell’Oltrepò Pavese nel corso dell’inverno 2004/2005 il valore massimo era stato di 25.9 ind./10 ha nella seconda metà dello stesso mese. Nell’inverno 1991/1992 anche nei prati in provincia di Macerata il picco 36 mento calante dell’abbondanza di entrambe le specie presso i margini alberati nel corso dell’inverno è sostanzialmente difforme rispetto a quanto evidenziato da diverse Migrazione e svernamento di allodola Alauda arvensis e pispola Anthus pratensis ricerche condotte in Inghilterra. Le scelte delle aree di fo- sfruttare ambienti più rischiosi, nutrendosi più velocemen- che possono essere tra loro in contrasto quali l’abbondanza del cibo, la sua accessibilità e il rischio di predazione. Relativamente all’alimentazione dell’allodola in inverno, numerosi studi (Wilson et al. 1996, Wakeham-Dawson e Aebischer 1998, Gillings e Fuller 2001, Donald et al. 2001b) hanno sottolineato come la specie preferisca pasturare nelle stoppie di cereali, prediligendo soprattutto quelle di orzo rispetto a quelle del frumento (Buckingham et al. 1999, Donald et al. 2001b). Ciò dipende dalla disponibilità di chicchi che, come evidenziato da Green (1978), forniscono a parità di quantità assunta il più elevato apporto calorico. In tutte le altre coltivazioni una componente rilevante dell’alimentazione è costituita dalle foglie delle dicotiledoni infestanti; queste infatti costituiscono il 24% della (Cresswell 1994, Roberts 1996). Le dimensioni e le forme dei campi e la presenza sui loro margini di siepi o alberature incidono sul livello di rischio percepito dagli uccelli e quindi sull’utilizzo dello spazio durante il foraggiamento. In particolare si è osservato che l’abbondanza delle allodole è positivamente correlata alla dimensione dei campi, ma decresce all’aumentare della lunghezza del perimetro per pi alte o alberi sui margini (Donald et al. 2001b). Il fatto di evitare campi piccoli con ai bordi siepi alte o alberature è stato spiegato da Robinson (1997) e da Gillings e Fuller (2001) proprio in termini di precauzione contro il rischio di predazione, infatti le strutture verticali prospicienti i campi possono essere utilizzate come posatoi dai rapaci, come nel caso di uno smeriglio Falco columbarius osservato sugli alberi ai margini dell’area di studio. Robinson e Sutherland (1999), pur confermando che le allodole evitano di pasturare vicino ai bordi dei campi con siepi o alberature, hanno rilevato che nei prati avvicendati nel corso dell’inverno, a differenza di quanto avviene nelle stoppie, gli uccelli tendono comunque ad avvicinarsi progressivamente ai margini e hanno ipotizzato che ciò dipenda dal calo di semi nella parte centrale dei campi. L’andamento rilevato in Inghilterra è dunque opposto a quanto da me osservato, infatti nell’area di studio la massima concenbre e poi è calata. La differenza probabilmente dipende dal maggiore livello di aggregazione delle allodole nell’area padana, infatti mentre nell’Inghilterra meridionale solo il 40% degli incontri invernali è relativo a gruppi con più di due individui, nell’area di studio la percentuale è stata et al. 1999). La prevalenza dei vegetali nella dieta invernale dell’allodola è confermata anche da studi condotti in Italia, anche se occasionalmente è stata rilevata la presenza di invertebrati, specialmente Curculionidi (Groppali e Bertocchi 1996). Nell’area di studio tra i vegetali infestanti a foglia larga è ampiamente dominante la veronica comune le cui foglie fanno normalmente parte della dieta dell’allodola (Cramp 1988). Negli ambienti prativi i semi sono più abbondanti in prossimità dei margini per la maggior presenza di erbe infestanti (Marshall 1989, Robinson e Sutherland 1999), inoltre al crescere dell’altezza della vegetazione aumenta la disponibilità alimentare sia di semi che di invertebrati (Curry 1994, Morris 2000, Perkins et al. 2000, Vickery et al. 2001), mentre l’accessibilità diminuisce e aumenta il rischio di predazione (Butler e Gillings 2004, Devereux et al. 2004). Tra le succitate componenti la più importante sembra essere l’accessibilità (Fuller et al. prato. A parità di condizioni gli animali si alimentano in posizioni poco rischiose, mentre scelgono punti pericolosi solo se esiste un evidente vantaggio energetico (Moody et al. 1996, Butler et al. 2005). In quest’ultima situazione gli uccelli possono mitigare l’aumento del rischio durante il foraggiamento incrementando la vigilanza (Lima e Dill 1990, Whittingham e Evans 2004, Devereux et al. 2004) oppure aggregandosi in gruppi (Elgar 1989). Quest’ultima opzione consente di ridurre il costo della sorveglianza sia perché è maggiore il numero d’individui che possono segnalare eventuali predatori (Elgar 1989, Krause e Ruxton 2002) sia in quanto il singolo individuo ha una minor probabilità di essere scelto da un predatore (Sirot 2006). La protezione offerta dal gruppo permette agli uccelli che lo compongono di alimentarsi in posizioni più esposte e di solo mese di dicembre. La maggior aggregazione ha permesso agli uccelli di alimentarsi nelle aree più vantaggiose quindi ad elevato livello di rischio. Col progredire della stagione, al calare sia dell’abbondanza complessiva sia del numero medio di individui per gruppo, l’allodola ha ridotto il rischio percepito spostandosi verso parti del prato più distanti dai margini alberati. Nell’analizzare i dati della pispola va considerato che la specie è essenzialmente insettivora, ma che in inverno può alimentarsi anche di semi, soprattutto di Poa sp. vegetazione e del terreno. Nel mese di dicembre la distribuzione nel prato è stata simile a quella dell’allodola e probabilmente anche per essa valgono le stesse motivazioni. Nei mesi successivi, pur con la cautela dovuta alla scarsi37 Ferlini tà dei dati, ho osservato con frequenza superiore alle attese singoli individui nei pressi dei margini alberati. Questo può essere spiegato dalle differenti preferenze della pispola rispetto all’allodola sia in termini di caratteristiche delle aree di foraggiamento che di strategia difensiva. Per l’allodola Wakeham-Dawson e Aebischer (1998) hanno rilevato una correlazione negativa fra densità e copertura del terreno, inoltre la specie quando avverte un pericolo preferisce fuggire involandosi (Robinson e Sutherland 1999). La pispola invece in presenza di un predatore spesso si appiattisce sul terreno cercando di mimetizzarsi, in ciò facilitata dalla frequentazione di aree con vegetazione più alta e densa (Whittingham et al. 2006). Le diversità fra le aree di foraggiamento utilizzate dalle allodole e dalle pispole evidenziate in Inghilterra trovano dunque conferma anche nei dati raccolti in ambito pale due specie. Le difformità invece rilevate nelle strategie di utilizzo dei prati in inverno rispetto alla situazione inglese, soprattutto per l’allodola, suggeriscono che eventuaza e contestualizzazione dei fenomeni in quanto non sempre è possibile mutuare le esperienze maturate in altre situazioni geoclimatiche. Ringraziamenti – Ringrazio Giuseppe Camerini e Francesca BIBLIOGRAFIA Barnett PR, Whittingham MJ, Bradbury RB, Wilson JD 2004. Use of unimproved and improved lowland grassland by wintering birds in the UK. Agriculture Ecosystems and Environment 102: 49-60. BirdLife International 2004. Birds in Europe: population estimates, trends and conservation status. Series N. 12. BirdLife International, Cambridge. Brichetti P, Fracasso G 2007. Ornitologia italiana. Vol. 4. Apoza e movimenti degli uccelli italiani. A. Perdisa Ed., Ozzano Emilia. Browne S, Vickery JA, Chamberlain D 2000. Densities and population estimates of breeding skylarks Alauda arvensis in Britain. Bird Study 47: 52-65. Buckingham DL, Evans AD, Morris AJ, Orsman CJ, Yaxley R 1999. Use of set-aside land in winter by declining farmland bird species in the UK. Bird Study 46: 157-169. Busche G 1989. Population crash of the skylark Alauda arvensis in the Schleswig-Hoplstein lowlands. Vogelwelt 110: 51-59. Butler SJ, Gillings S 2004. Quantifying the effects of habitat structure on prey detectability and accessibility to farmland birds. In: Ecology and Conservation of Lowland Farmland Butler SJ, Whittingham MJ, Quinn JL, Cresswell W 2005. Quantifying the interaction between food density and habitat 38 structure in determining patch selection. Animal Behaviour ta della pianura bresciana (1988-1998). Pianura 11: 147-154. Chamberlain DE, Fuller RJ, Bunce RGH, Duckworth JC, Shrubb M 2000. Changes in the abundance of farmland birds in reCoordinamento Progetto MITO2000 2006. Possibili andamenti di conservazione dell’avifauna italiana 2000-2005. www.mi[1/2008]. Cramp S (ed) 1988. Handbook of the birds of Europe, the Middle East and North Africa: The birds of the Western Palearctic, Vol. 5. Oxford University Press, Oxford. Cresswell W 1994. Flocking is an effective anti-predation strategy in redshanks, Tringa totanus soil fertility and effects on plant growth. Chapman & Hall, London. de Carli E, Fornasari L, Bani L, Bottoni L 1998. Trend in distribution, abundance and habitat features of skylark Alauda arvensis Devereux CL, McKeever CU, Benton TG, Whittingham MJ 2004. The effect of sward height and drainage on starlings Sturnus vulgaris and japwings Vanellus vanellus foraging in grassland habitats. In: Ecology and conservation of lowland farmland birds II: the road to recovery. Ibis 146 (Suppl. 2): 115122. tion and the collapse of Europe’s farmland bird populations. Proceedings of the Royal Society of London B 268: 25-29. Donald PF, Buckingham DL, Moorcroft D, Muirhead LB, Evans AD, Kirby WB 2001b. Habitat use and diet of skylarks Alauda arvensis wintering on lowland farmland in southern Elgar MA 1989. Predator vigilance and group size in mammals and birds: a critical review of the empirical evidence. Evans A 1997. The importance of mixed farming for seed-eating birds in the UK. Farming and birds in Europe. In: DJ Pain, MW Pienkowski (eds), The common agricultural policy and its implications for bird conservation. Academic Press, Ferlini F 2006. Variazioni stagionali di abbondanza dell’allodola Alauda arvensis 69-72. Ferlini F 2007. Ciclo annuale della comunità ornitica in un’area agricola dell’Oltrepò Pavese. Pianura 21: 171-185. Fornasari L, Bottoni L, Massa R, Fasola M, Brichetti P, Vigorita V (eds) 1992. Atlante degli uccelli svernanti in Lombardia. Regione Lombardia-Università degli Studi di Milano, Milano. Fuller RJ, Atkinson PW, Asteraki EJ, Conway GJ, Goodyear J, Haysom K, Ings T, Smith REN, Tallowin JR, Vickery JA invertebrates and birds. Report to DEFRA on commissioned for Ornithology, Thetford. Gillings S, Fuller RJ 2001. Habitat selection by skylarks Alauda arvensis Green RE 1978. Factors affecting the diet of farmland skylarks Alauda arvensis Gregory RD, Noble DG, Custance J 2004. The state of play of farmland birds: population trends and conservation status of lowland farmland birds in the United Kingdom. Ibis 146: Migrazione e svernamento di allodola Alauda arvensis e pispola Anthus pratensis Groppali R, Bertocchi B 1996. Contenuti stomacali e alimentazione di dieci specie di Passeriformes in Italia. Rivista Italiana di Henderson IG, Vickery JA, Carter N 2004. The use of winter bird crops by farmland birds in lowland England. Biological ISTAT 2007. Struttura e produzioni delle aziende agricole - Anno 2005. Servizio Agricoltura, Roma. Krause J, Ruxton GD 2002. Living in groups. Oxford University Press, Oxford. Laiolo P 2005. Spatial and seasonal patterns of bird communities in Italian agroecosystems. Conservation Biology 19: 15471556. Lima SL, Dill LM 1990. Behavioural decisions made under the risk of predation: a review and prospectus. Canadian Journal of Zoology 68: 619-640. Manzi A, Perna P 1992. Lo svernamento degli uccelli praticoli in relazione alle colture ed alla struttura della vegetazione erbacea nelle aree agricole della “Riserva Naturale Abbadia di Fiastra” (Italia Centrale). Atti V Congresso Nazionale della Marshall EJP 1989. Distribution patterns of plants associated with Moody AL, Houston AI, McNamara JM 1996. Ideal free distribution under predation risk. Behavioural Ecology and SociMoorcroft D, Whittingham MJ, Bradbury RB, Wilson JD 2002. Moreira F, Beja P, Morgado R, Reino L, Gordinho L, Delgado A, context on grassland wintering birds in Southern Portugal. Agriculture. Ecosystems and Environment 109: 59-74. Morris MG 2000. The effects of structure and its dynamics on the ecology and conservation of arthropods in British Grassland. Biological Conservation 95: 129-142. Nardo A, Stival E 1996. Allodola Alauda arvensis. In: Stival E (ed). Atlante degli uccelli svernanti in provincia di Venezia, Newton J 2004. The recent declines of farmland bird populations in Britain: an appraisal of causal factors and conservation actions. Auk 146: 579-600. Peach WJ, Siriwardena GM, Gregory RD 1999. Long-term changes in over-winter survival rates explain the decline of reed buntings Emberiza schoeniclus in Britain. Journal of Applied Roberts G 1996. Why individual vigilance declines as group size increases. Animal Behaviour 51: 1077-1086. Robinson RA 1997. Ecology and conservation of seed-eating birds on farmland. PhD Thesis. University of East Anglia, Norwich. Robinson RA, Sutherland WJ 1999. The winter distribution of seed-eating birds: habitat structure, seed density and seasonal depletion. Ecography 22: 447-454. ca sulla migrazione autunnale dell’Allodola Alauda arvensis. Avocetta 27 (Numero speciale): 48. Siriwardena GM, Baillie SR, Buckland ST, Fewster RM, Marchant JH, Wilson JD 1998. Trends in the abundance of farmland birds: a quantitative comparison of smoothed common bird Sirot E 2006. Social information, antipredatory vigilance and Stoate C, Boatman ND, Borralho RJ, Rio Carvalho C, de Snoo real crops, dry pasture and shrub-steppe in determining skylark Alauda arvensis densities in the Iberian peninsula. Agriculture, Ecosystems and Environment 95: 551-557. Suárez F, Garza V, Oñate JJ, Garcia de la Morena EL, Ramirez A, Morales MB 2004. Adequacy of winter stubble maintenance for steppe passerine conservation in central Spain. Agriculture, Ecosystems and Environment 104: 667-671. Sutherland WJ 1996. From individual behaviour to population ecology. Oxford University Press, Oxford. Thomson DL, Baillie SR, Peach WJ 1997. The demography and ods of population stability and decline. Journal of Animal Ecology 66: 414-424. by invertebrate-feeding birds in winter. Journal of Applied Ecology 29: 779-790. Vickery JA, Tallowin JR, Feber RE, Asteraki EJ, Atkinson PW, Fuller RJ, Brown VK 2001. The management of lowland neutral grasslands in Britain: effects of agricultural practises on birds and their food resources. Journal of Applied Ecology Perkins AJ, Whittingham MJ, Bradbury RB, Wilson JD, Morris AJ, Barnett PR 2000. Habitat characteristics affecting use of lowland agricultural grassland by birds in winter. Biological Conservation 95: 279-294. Potts GR 1986. The partridge: pesticides, predation and conservation. Collins, London. Wakeham-Dawson A, Aebischer NJ 1998. Factors determining winter densities of birds on environmentally sensitive area arable reversion grassland in southern England, with special reference to skylarks (Alauda arvensis). Agriculture, Ecosystems and Environment 70: 189-201. Whittingham MJ, Evans KL 2004. The effects of habitat structure on predation risk of birds in agricultural landscapes. In: Ecology and conservation of lowland farmland birds II: the road to recovery. Ibis 146 (Suppl. 2): 115-122. Whittingham MJ, Devereux CL, Evans AD, Bradbury RB 2006. Altering perceived predation risk and food availability: man- Roberts HA, Dawkins PA 1967. Effect of cultivation on the numbers of viable weed seeds in soil. Weed Research 7: Wilson JD, Taylor R, Muirhead LB 1996. Field use by farmland Associate Editor: G. Tellini Florenzano 39 Avocetta 35: 41-42 (2011) Observation of vocal mimicry of great reed warbler Acrocephalus arundinaceus imitating nightingale Luscinia megarhynchos song PIER LUIGI BERAUDO1, BRUNO CAULA2 1 2 Via Monviso 7, 12040 Salmour (CN) ([email protected]) Via G.Matteotti 25, 12100 Cuneo Abstract – Description of a great reed warbler Acrocephalus arundinaceus imitating the nightingale Luscinia megarhynchos song. An individual was heard and seen several times during June 2007 and May-June 2010 in a wetland area in Cuneo Province with a song similar to the nightingale song. This phenomenon has not been described before for this species yet. Riassunto – Viene descritto un caso di mimesi vocale da parte di cannareccione Acrocephalus arundinaceus imitante il canto di usignolo Luscinia megarhynchos. Un individuo è stato udito e osservato in più occasioni nel giugno 2007 e nel maggio-giugno 2010 in un’area palustre in Provincia di Cuneo con un canto avente caratteristiche tipiche del canto di usignolo. Tale fenomeno risulta non ancora descritto per la specie. We here describe a series of observations occurred within the protected area of “la Madonnina” (Special Zone of Protection no. IT1160059 7°41’57.21”E- 44°29’48.63”N), a wetland area of 22 hectares located along the River Stura di Demonte at Sant’Albano Stura (Cuneo, Piedmont, Italy). On 13 June 2007, we noticed a great reed warbler Acrocephalus arundinaceus that uttered an imitation of the song of the nightingale Luscinia megarhynchos. Every year, this area contains 1-3 territorial and breeding great reed warblers and 4-5 territorial nightingale males (Beraudo P.L. and Caula B. pers. obs.). We heard the same song imitation throughout the breeding season (from June to August). We suspected that it was the same individual as it was always found in a small isolated patch of reedbeds of Typha latifolia. The imitation included a few “karrakarra” notes typical of the great reed warbler song (Kennerley and Pearson 2010) plus an articulated melodic note phrasing that, to human ear, was similar to the nightingales song. Three years later, still in the same area, on 30 May 2010, we observed a great reed warbler performing again the same song imitation. Also this time, the song was composed of a few “karra-karra” typical of this species plus a series of warbling notes similar to the nightingale song. © 2011 CISO - Centro Italiano Studi Ornitologici We heard the song imitation until 12 June, after which the typical song of the great reed warbler prevailed with randomly alternating a few typical notes of the nightingale. In one instance, on 30 May 2010, we recorded the song imitation from a distance of about 60 meters with a directional and parabolic microphone LiSN LS370 with a Roland R09HR recorder (audio settings: Wave 96, Hz/24 bits). We obtained one oscillogram of the audio recording by using the software Wave Lab 4 Steinberg. It was compared with both the typical song of the species and with that of the nightingale, both of which obtained from a CD available in the market (Roché 1990). From a visual analysis of the oscillogram patterns, it was possible to note a pattern similarity between a few parts of the song imitation and the nightingale song and, simultaneously, a difference between the song imitation and the song typical for great reed warblers (Fig. 1). The song imitation and nightingale song showed a peak of 4000 Hz whereas the great reed warbler song showed a peak of 6000 Hz. Vocal mimicry is a behaviour quite common among the Acrocephalus species with records detected in A. paludicola, A. agricola, A. dumetorum, A. palustris e A. scirpaceus (Snow and Perrins 1998). The great reed warbler, however, is known to possess a limited song repertoire and no vocal mimicry has been recorded for this 41 Beraudo and Caula A) SONG IMITATION B) NIGHTINGALE C) GREAT REED WARBLER Figure 1. (A) Oscillogram obtained from one audio recording of a great reed warbler imitating a nightingale song in the wetland “la Madonnina” (Cuneo, Italy). Song imitation is compared with the song typical of nightingales (B) and great reed warblers (C). Similarities are highlighted by the same colours. species yet (Snow and Perrins 1998, Brichetti and Fracasso 2010, Kennerley and Pearson 2010). Acknowledgments – We would like to thank M. Pettavino for the audio recordings, M. Gallizio for processing sonograms and frequency analyses, and L. Piretta e M. Pagliero for the English translation. REFERENCES Brichetti P, Fracasso G 2010. Ornitologia Italiana. vol. 6 . Sylviidae-Paradoxornithidae. Oasi A. Perdisa Editore, Bologna. Kennerley P, Pearson D 2010. Reed and bush warblers. Helm Roché JC 1990. Tous les oiseaux d’Europe. CD no. 3. Sittelle Ed., Mens, France. Snow DW, Perrins CM, 1998. The birds of the western Palearctic. Concise edition. Vol. 2. Passerines. Oxford University Press, Oxford. Associate Editor: G. Tellini Florenzano 42 Breeding habitat and nesting site of the red-backed shrike Lanius collurio in farmland of the Marche region, Italy FEDERICO MORELLI1, MASSIMO PANDOLFI2 1 Dipartimento di Scienze dell’Uomo, dell’Ambiente e della Natura, Università degli Studi di Urbino “Carlo Bo” Abstract – In this work we studied some characteristics of nesting sites of red-backed shrike Lanius collurio in some areas of the Marche Region (Central Italy). These areas are characterized by a temperate climate and by mainly agricultural cover. We analyzed the breeding site macrohabitat and the nest microhabitat. Results showed a prevalence of shrubs, most commonly Prunus spinosa and Rosa canina, as nest support. The nest is generally located at mid height (1.39 m) and in the midpoint of the shrub. Nesting sites were located mainly in the edge zone of the vegetation patches and nearby the roads. In over 65 % of cases the nests were built less than 5 meters far from roads. Results highlight the importance of some vegetation species and the presence of certain environmental structures (presence of shrubs, tree rows and other marginal habitats of farmland areas) for the preservation of this species, whose conservation status in Italy and Europe is currently unfavourable. INTRODUCTION Populations of red-backed shrike Lanius collurio are currently decreasing in number and size throughout the world (Yosef 1994). The European population, considered in the last decades to be in moderate decline, is estimated between 6.300.000 and 13.000.000 pairs, but in the last years it appears rather stable and shows a constant short term trend (PECBMS 2008). The Italian breeding population has been estimated between 50.000 and 120.000 pairs (Birdlife International 2004). However, this species still remains the commonest of the European Laniidae, distributed from the Iberian Peninsula to southern Scandinavia and eastwards to the Ukraine, with Sicily (where it is scarce), Greece and Turkey forming its southern limit. In Italy it is present in all regions as a regular migrant and breeding species during summer (Foschi and Gellini 1987, Meschini and Frugis 1993, Dinetti 1997). As elsewhere, in the Marche Region once widespread this species has be- For nesting the red-backed shrike prefers transition zones between woods and grassland, tree-rows and thick hedgerows often bordering roads, open country with shrub © 2011 CISO - Centro Italiano Studi Ornitologici or tree cover (Cramp and Perrins 1993, Lefranc 1993) and open parks and gardens on the outskirts of towns. Its typical feeding habitat is farmland, often abandoned, with scattered trees or shrubs providing natural perches for hunting (Glutz von Blotzheim 1962, Lefranc 1993, Tucker et al. 1994, Farkas et al. 1997, Kuzniak and Tryjanowski 2000, Tryjanowski et al. 2000). In this study we analysed red-backed shrike nesting habitat characteristics at four different locations in farmland in the River Foglia catchment area in central Italy. We made a detailed assessment of nest-site features. The selected parameters describe the natural habitats and vegetation type selected for nesting, the nest site microhabitat and the level of human presence in the area (proximity to roads, buildings and villages). These information could help to explain the local distribution of the breeding population of the red-backed shrike (Morelli et al. 2007). Moreover, identifying the main factors affecting nest site selection could be of value in developing effective strategies for the preservation of the red-backed shrike at both local and the agro-environmental schemes currently followed. 43 METHODS Study area Fieldwork was carried out in two ‘Special Protection Zones’ (ZPS), namely ZPS 4 “Badland and dry grassland - Mid-Foglia Valley” and ZPS 7 “Mombaroccio and Beato Sante”, located in the River Foglia catchment area near the northern boundary of the Marche Region. Four macro-areas occupied by nesting pairs were surveyed in detail, covering a total of 780 hectares (Fig. 1). Data collected The data were collected during the 2006 and 2007 breeding seasons. After locating nesting pairs by direct observation during arrival, courtship and nest-building (from mid May to the end of June), their territorial distribution was recorded and plotted as points on the map. When nests ing site”. The nest microhabitat was characterized according to the following parameters: 1) plant species where nest was built; 2) plant height (meters); 3) nest height from ground (meters); 4) nest position within the shrub crown, described as one of six possible positions obtained by combining height - adopted in the synphytosociological map of Marche Region (Catorci et al. 2007); 3) nest location in the habitat (in a shrub / in a tree / on the ground); 4) environment surrounding the nesting sites; 5) distance from road (i.e. distance in meters between the nest and the nearest road); road, track); 7) distance from built-up areas (i.e. distance in meters from the nest to the nearest village); 8) distance from isolated houses (i.e. distance in meters from the nest to the nearest house). Were also recorded the following parameters of redBacked shrikes: number of neighbouring nests around the nest site (within a 500 m radius) and distance in meters from the nearest nest. Monitoring frequency After locating the nest sites, all territories were monitored regularly at least once a week in order to cover all the various stages of the breeding phenology (Blondel 1985, Bibby et al. 1997). The number of nest checks was kept to a minimum to avoid disturbing the nesting pairs (Tryjanowrameters were recorded at the end of the breeding season, proximal or distal along the horizontal axis) (Tab. 1). The macrohabitat was characterized by means of the following parameters: 1) area (square meters) of the vegetation type where the nest was built; Figure 1. Study area in the Marche region, Central Italy. 44 Nesting sites and GIS Many of the macrohabitat parameters were calculated by means of a Geographical Information Systems (GIS) analysis of the nesting site and surrounding environment, using Breeding habitat and nesting site of the red-backed shrike Table 1. Nest position within the shrub crown. The vertical axis represents the proportional height in the plants. The horizontal axis represents the position in relation to the shrub trunk. Vertical axis Horizontal axis proximal distal A3 A2 A1 B3 B2 B1 the vegetation physiognomies map (Catorci et al. 2007) and the Marche Region CTR maps (Technical Regional Cartography) with the following thematic layers: buildings, hydrography, altitude and road network. The nests of the species were digitized at 1:500 scale using ESRITM ArcGIS 9 software, as plots on the map. The nestthe nest, corresponding to the territory occupied by shrikes pairs during the breeding season (Cramp and Perrins 1993, Lefranc 1993). Statistical analyses The red-backed shrike nest data gathered during the two monitoring years were compared using ANOVA and Fisher test. The same tests were run to compare data collected in the various breeding sites. Chi-square tests were used to compare the discrete variables. The measures are presented as mean values, with max and minimum values. All tests were carried out using the SPSS v. 13.0 software package. RESULTS A total of 50 nests were monitored (Tab. 2): 16 during 2006 and 34 during 2007. As the mean values of the studone year to the next or between the various localities (all F tests, P > 0.05), they were considered as belonging to a single pool of data. Of the 50 nests, 43 were located in ZPS 4 (86.0 %) and 7 in ZPS 7 (14.0 %). Spatial distribution of the red-backed shrike population The mean density of red-backed shrike pairs was 0.64 ± 0.10 pairs/10 ha. The mean distance between nests was 316.90 ± 245 m, with a maximum distance of 1100 m and a minimum of 65 m. The elevation of the four nesting areas ranged from a minimum of 70 m (in ZPS 4) to a maximum of 420 m a.s.l. in ZPS 7. Microhabitat characteristics The vast majority of nests studied were built in shrubs (96 2 = 80,39; df = 2; P < 0.01); only one nest was built on the ground (2 %) and it was well protected by shrub foliage, while one other nest was located on a tree (2 %). The shrub species most commonly used as a nest support was Prunus spinosa (54 % of cases), followed by Rosa canina (30 %) and Crataegus monogyna (10 (Fig. 2). The height of shrubs chosen for nesting ranged from a maximum of 4 m to a minimum of 1.7 m (mean = 2.79 m; SD = 0.54; N = 49). The nest position within the shrub 2 = 12.13; df = 2; P < 0.01), and for central (proximal) position on the horizontal axis (A1, A2 and A3) in over 65 % of cases (Fig. 3). tween the two years of the study (mean = 1.36 m in 2006 and 1.40 m in 2007; F test = 1.64, p: 0.21). The mean nest height was 1.39 m with a max. height of 3 m and a minimum of 0.1 m (excluding one single case of a nest on Table 2. Red-backed shrike nests and their macrohabitat parameters as recorded during the two study years. Number of nests Surrounding environment Mean surface of vegetation patches where the nests were positioned (m2) 27 7 5 3 2 2 2 1 1 farmland with scattered shrubs farmland with hedgerows farmland and uncultivated shrubs and tree-rows uncultivated with shrubs tree-rows shrubs farmland and riparian farmland and vineyards 47.9 51.8 30.0 55.6 31.1 49.2 37.5 23.0 25.0 45 Table 3. Shrub and nest height (m). Prunus spinosa Rosa canina Crataegus monogyna Rubus ulmifolius Paliurus spina-christi Mean Maximum Minimum SD N Shrub height Nest height 2.79 4.5 1.6 0.76 48 1.39 3.0 0.1 0.63 47 Quercus cerris Unpaved roads were more common (53.2 %) than paved Figure 2. Plant species used as nest support in percentage. 2 the ground, which was in central position and under thick shrub cover) (Tab. 3). Macrohabitat characteristics The main vegetation type of the nesting sites consisted of farmland with shrubs, and to a lesser extent tree-rows or hedgerows. Most nests were built in shrubland. The mean surface of the vegetation patches containing nests was 46.2 m2 (N: 50), with a maximum of 300 m2 and a minimum of 6 m2. The majority of nests (86.1 %) was located along the edges of patches rather than internally (13.9 %), a highly 2 = 21.34; df = 1; P < 0.05; Yate’s correction). The vegetation type surrounding the nest sites consisted mainly of farmland and uncultivated land. Roads were present in all the nesting areas studied. 10,02% 8,16% A3 B3 36,73% 24,48% A2 B2 24,40% 0% A1 B1 Figure 3. Diagram of nest position within the shrub crown. 46 = 0.17; df = 1; P > 0.05; Yate’s correction). The mean distance from nests to the nearest road was 12.0 m. However, over 75 % of the nests were built less than 12 meters from a road (Fig. 4). Over 65 % of the nests were located less than 1000 meters from the nearest village: the mean distance was 971.3 m. The mean distance between the nests and the nearest house was 229.5 m (Tab. 4). DISCUSSION As during the last decades red-backed shrike populations are considered in decline, the species has been the subject of quite detailed research in recent years throughout its European range (Luise 1991, Lefranc 1993, Lugger 1993, Farkas et al. 1997, Tryjanowski et al. 2000, Latus et al. 2004). Studies focusing on the species habitat preferences are of particular interest, given that it frequents developed areas subject to rapid change such as farmland (Donald et al. 2006) and transitional or ecotonal zones. The type of nesting habitat typically chosen by the red-backed shrike in central Italy consists principally of farmland with patches of shrubs, tree-rows or occasional isolated trees, in areas of low hills or lowlands. For nestfor mainly tall shrub species (Lefranc 1993, Farkas et al. 1997, Tryjanowski et al. 2000). The shrubs most commonly used in our study area were Blackthorn Prunus spinosa and Dogrose Rosa canina et al. 1997, Guerrieri and Castaldi 2006). In our study area we have almost no cases of nesting on trees, but the choice of nest trees are strongly dependent from availability of some species Comparing the results of our study with those obtained in another region (Latium) in central Italy with temperate climate (Guerrieri and Castaldi 2006), we found that the mean density of breeding pairs was conspicuously low- Breeding habitat and nesting site of the red-backed shrike 70 60 % records 50 40 30 20 10 0 0-5 > 5-10 > 10-25 > 25-50 > 50 distance (m) Figure 4. Distance from the nest to the nearest road. er – 0.64 versus 1.66 pairs/10 hectares – in our region results from Engadin (southeast Switzerland), where a density of 5.4 pairs/10 ha was found (Pasinelli et al. 2007). The mean height of shrubs used for nesting was similar in the Marche (2.79 ± 0.54 m) and in Latium (2.31 ± 0.82 m). Also the mean nest heights recorded by the two studies (1.39 ± 0.63 m vs. 1.35 ± 0.57 m) were practically identical. Likewise, in both studies the nest position within the most commonly used shrub was A2 and B2 on the vertical axis, with 59% of cases overall in our study versus 57.5% in Guerrieri and Castaldi (2006). In addition, over 64% of the checked nests were positioned at the centre of the shrub crown, where they are most protected by the dense foliage. The predominant vegetation types in the areas around the nest site were: farmland (62%), shrublands (26%), unculhedges (1%). The breeding habitats in the areas that we studied were fragmented by roads (paved, unpaved and tracks). This observation highlights the shrike’s strong tendency to use roadside shrubs as nesting sites or perches (Cramp and Perrins 1993, Lefranc 1993), a tendency fostered by the long-standing local tradition of planting hedges and verges along country roads; these generally consist of Crataegus sp., Prunus spinosa, Paliurus spina-christi, Ligustrum vulgare Over 65% of nests were located less than 5 m from road edges. In many of these cases there were other shrubs available as potential nest sites within the nesting area, but located further away from roads. Although we did not spethe species actively prefers closeness to a road when selects its nest microhabitat. A parameter not taken into account in our study was the disturbance caused by road trafveyed near nest sites were used regularly. This fact would shrike nest site selection negatively, a feature already noted among other Laniidae which nest in Europe (Bechet et al. 1998). The presence of roads within the nesting habitat shows that territorial fragmentation due to the road network (but not highway) may be a positive factor for the distribution of this species: besides providing suitable nest sites (i.e the aforementioned roadside shrubs) (Morelli 2011), it offers sects and micromammals (Lefranc 1993), that is the opportunity to exploit the exposed road surface as a rich huntvious studies (Bechet et al. 1998). The shrubs along roads Table 4. Distance between nests and building structures (m). MEAN MAX MIN N Distance from road Distance from village Distance from house 12.03 150 0.5 47 971.32 3000 150.0 47 229.50 500 10.0 47 47 can offer suitable nest sites but also represent “ecological them (Mumme et al. 2000). Nonetheless some animals seem unaffected by the presence of roads (Trombulak and Frissell 2000) and in the studied area the risk of mortality from collision with vehicles seem to be very low. shrike nest habitat use in the Marche and could contribute to creating a broader knowledge base on the habitats used by this species in this region. The opportunity offered by tools such as GIS (Salem 2003) to characterise and decies would prove to be extremely useful for identifying the principal risk factors and hence the correct strategies on which to base practical guidelines for the conservation of this species. Producing regional maps for Lanius collurio would be important, given that this information is essential for the Farmland Bird Index survey, currently in development in the European Union and useful to assess the conservation status of the agricultural environment by monitoring the presence of a series of indicator species (Gregory et al. 2005). Our results show the importance of certain vegetation types for nest site selection by red-backed shrike. The presence of hedgerows with trees, vegetated road verges or tree-rows (much used in the past to divide up the various bution of this species. All these factors contribute to the quality of the red-backed shrike nesting habitat (Lefranc 1993, Pasinelli et al. 2007, Morelli 2012) and for this reason require more active management. For example, local authorities could introduce schemes to register the presence and use of certain shrubs such as Crataegus sp. and Prunus spinosa in roadside verges, as agricultural mosaic boundaries and to promote their conservation. In fact, the decision to preserve and restore local vegetation can be well motivated by the fact that it constitutes the only real, tangible link with the natural history of the area concerned of environment (e.g. woodland and farmland) to provide a favourable habitat for insects, small mammals and other animals. Measures of this type should be thought as an integral part of the Marche Region’s agricultural and rural development policies. These conservation guidelines should also help a reassessment of other issues (e.g. the territorial fragmentation may be viewed not as factors not negative but rather potentially increasing the nesting habitat options available to shrikes and other species. In order to understand the eco48 logical units which compose the agricultural environment (Biondi et al. 2007) and reconstruct the complex web of habitat interrelations, a cohesive set of such environmental management measures should be developed, and then monitored constantly for testing their contribution to local biodiversity. Acknowledgements – We thank Nicola Baccetti, Adriano De Faveri, Emilio Baldaccini, Riccardo Santolini, Mauro Furlani and Maria Balsamo for their useful comments; Yanina Benedetti, Paolo Magalotti, Alessandro Fosca and Catia Berzigotti for helping in the English version of the manuscript and the anonymous referees for the improvements of the text. REFERENCES Bechet A, Isenmann P, Gaudin R 1998. Nest predation, temporal and spatial breeding strategy in the woodchat shrike Lanius senator in Mediterranean France. Acta Oecologica 19: 81-87. Bibby CJ, Burgess ND, Hill DA 1997. Bird census techniques. Academic Press, London. Biondi E, Casavecchia S, Catorci A, Foglia M, Galassi S, MorelF, Vitanzi A, Angelini E, Bianchelli M, Zabaglia C 2007. Il progetto di “Rete Ecologica della regione Marche” (REM): per il monitoraggio e la gestione dei siti Natura 2000 e l’orCongresso della Società Italiana di Scienza della Vegetazione: “L’applicazione della Direttiva Habitat in Italia e in Europa”, Ancona, Giugno 2007. BirdLife International 2004. Birds in Europe: population estimates, trends and conservation status. BirdLife Conservation Series N.º 12, BirdLife International, Cambridge. Blondel J 1985. Bird distribution and abundance. Some technical and theoretical comments. In: Taylor K, Fuller RJ and Lack PC (eds). Bird census and atlas studies. British Trust for Ornithology, Tring, pp. 3-14. Catorci A, Biondi E, Casavecchia S, Pesaresi S, Vitanzi A, Foglia A, Galassi S, Pinzi M, Angelini E, Bianchelli M, Ventrone F, Cesaretti S, Gatti R 2007. La carta della vegetazione e degli elementi di paesaggio vegetale delle Marche (scala 1:50.000) per la progettazione e la gestione della rete ecologica regionale. Fitosociologia 44 (suppl. 1): 115-118. Cramp S, Perrins CM (eds) 1993. The birds of the Western Palearctic, Vol. 7. Oxford University Press, Oxford. Dinetti M 1997. Averla piccola, Lanius collurio. In: Tellini Florenzano G, Arcamone E, Baccetti N, Meschini E, Sposimo 1992). Quaderni del Museo di Storia Naturale di Livorno, Further evidence of continent-wide impacts of agricultural culture, Ecosystems and Environment 116: 189-196. Farkas R, Horvath R, Pasztor L 1997. Nesting success of redbacked shrike, Lanius collurio in a cultivated area. Ornis Hungarica 7: 27-37. vincia di Forlì. Maggioli, Rimini. Glutz von Blotzheim U 1962. Die Brutvögel der Schweiz. Schweizerische Vogelwarte Sempach, Aarau. Breeding habitat and nesting site of the red-backed shrike Lanius collurio nests in the agricultural landscape of eastern Poland. Notatki Ornitologiczne 48: 273-277. Gregory RD, van Strien A, Vorisek P, Gmelig Meyling AW, Noble D, Foppen R, Gibbons DW 2005. Developing indicators for European birds. Philosophical Transactions of the Royal Society B 360: 269-288. zione, densità e biologia riproduttiva dell’Averla piccola, Lanius collurio, in Italia centrale. Avocetta 29: 5-11. Kuzniak S, Tryjanowski P 2000. Distribution and breeding habitat of the red-backed shrike Lanius collurio in an intensively used farmland. Ring 22: 89–93. Latus C, Schultz A, Kujawa K 2004. Occurrence of the redbacked shrike, Lanius collurio depends on natural factors and mode of land use in the Quillow catchment, Germany. Biological Letters 41: 87-93. Lefranc N 1993. Les pies-grièches d’Europa, d’Afrique du nord et du Moyen-Orient. Delachaux et Niestlé, Lausanne. Lugger U 1993. The effect of habitat quality on breeding performance in the red-backed shrike Lanius collurio. Behavioural Processes 28: 235. Luise E 1991. Biologia riproduttiva e aspetti etologici dell’averla piccola (Lanius collurio) in Valmenera (Cansiglio, Prealpi Venete). Tesi di Laurea. Università degli Studi di Padova. lia. Supplemento alle Ricerche di Biologia della Selvaggina 20: 1-218. Morelli F. 2011. Importance of road proximity for the nest site selection of the red-backed shrike Lanius collurio in an agricultural environment in Central Italy. Journal of Mediterranean Ecology 11:21-29. Morelli F. 2012. Plasticity of habitat selection by red-backed shrikes Lanius collurio breeding in different landscapes. The Wilson Journal of Ornithology 124:52-57. monitoraggio e variabili degli habitat per la costruzione di modelli di distribuzione delle specie di uccelli nella regione Marche, Italia. Fitosociologia 44 (suppl. 1): 127-132. Mumme RL, Schoech SJ, Woolfenden GE, Fitzpatrick JW 2000. Life and death in the fast lane: demographic consequences of road mortality in the Florida scrub-jay. Conservation Biology 14: 501-512. vento nella progettazione di ripristino dell’ambiente a scopi naturalistici. In: Urbinati C., Ubaldi D., Gubellini L., PoggiaQuaderni dell’Ambiente n. 5, Assessorato Beni e Attività Ambientali, Provincia di Pesaro e Urbino, Pesaro. Rivista italiana di Ornitologia 57: 221-237. ro. Centro Stampa Amministrazione Provinciale di Pesaro e Urbino, Assessorato Ambiente Provincia di Pesaro e Urbino, Pesaro. Pasinelli G, Müller M, Schaub M, Jenni L 2007. Possible causes and consequences of philopatry and breeding dispersal in redbacked shrikes Lanius collurio. Behavioral Ecology and Sociobiology. 61:1061-1074. PECBMS 2008. Trends of common farmland birds in Europe. http://www.birdlife.cz/index.php?ID=1320). Salem BB 2003. Application of GIS to biodiversity monitoring. Journal of Arid Environments 54: 91-114. Trombulak SC, Frissell CA 2000. Review of ecological effects of roads on terrestrial and aquatic communities. Conservation Biology 14: 18-30. Tryjanowski P, Kuzniak S 1999. Effect of research activity on the success of red-backed shrike, Lanius collurio nests. Ornis Fennica 76: 41-43. Tryjanowski P, Kuzniak S, Diehl B 2000. Does breeding performance of red-backed shrike, Lanius collurio, depend on nest site selection? Ornis Fennica 77: 137-141. Tucker G, Heath M, Tomialojc’ L, Grimmett RFA 1994. Birds in Europe, the conservation status. Birdlife Conservation series Witt R 1987. Cespugli e arbusti selvatici. Franco Muzzio Editore, Padova. Yosef R 1994. Conservation commentary: Evaluation of the global decline in the true shrike, family Lanidae. Auk 111: 228233. Associate Editor: D. Campobello 49 Avocetta 35: 51-52 (2011) Difference in nest concealment and mortality rate in house sparrow Passer domesticus in urban and rural areas of Lucknow, India ABHIJIT MAZUMDAR1, PRABHAT KUMAR2 1 2 3-B Murlinagar, Cantt Road - 226001 Lucknow UP (India) ([email protected]) 319 Indra Nagar - Lucknow UP (India) Abstract – house sparrow Passer domesticus in urban and rural areas of Lucknow, India. We found to the loss of natural nesting sites due to anthropogenic factors in urban areas. INTRODUCTION Birds breed in urban as well as rural areas. However, differences have been observed in their breeding ecology in the two areas. Salvati et al. (1999) studied breeding ecology of kestrels Falco tinnunculus in urban, suburban and rural areas of central Italy and found nest density very high at city centre (1.9 pairs/km2) and high in suburbs (0.6 pairs/ km2). Breeding success was consistent with that of other among study areas in density, spacing, use and reoccupation of nest sites. The house sparrow Passer domesticus is a resident species and a commonly sighted bird in India. It feeds on insects and grains. It breeds from March to June in north India, September and October in central India and throughout the year in southern India (Ali 1992). These birds build well-concealed nests where lay eggs and raise their young. We studied nest concealment of these birds, attack of predators on their nests and their mortality rate in urban and rural areas of Lucknow, India. nests we observed parental behaviour in nest construction wherein birds returning with dry grass and leaves led us to under-construction nests. We searched for nests relying on information from local people. Bird droppings at times led us to the nests. A 8X42 binocular and 40X telescope were used to study predatory attacks on the nests. The nests were marked with a wooden stake at a 10m distance from them. The nests were observed every second day (two hours in the morning, two in the afternoon and two at night). All mean values are accompanied with standard deviation (SD). We measured nest concealment from four directions (North, East, South, West) at 1m distance from the nest at nest height level. We estimated mean percentage of the nest concealed to nearest 10% (Burhans 1997). For example, a nest visible 20% received an 80% score. RESULTS METHODS The rural nests were better concealed with a score of 65%80% (72.2±2.6) as against urban nests 30%-45% (34±3.2). A two-tailed t-test revealed the difference between urban We located 40 nests of the house sparrow in urban areas of Lucknow (26°, 55¢N, 80°, 59¢E: 450 meters above sea level), India, in a 64 km2 area and another 80 nests on the city’s outskirts (64 km2) among dense vegetation and farmland, from March 2009 to June 2009. For locating the P<0.05). We studied the attack of predators on urban and rural nests. In all 15 urban nests were attacked by predators: one attack not harmful to the brood, 5 attacks on eggs, 9 attacks on nestlings in which 36 nestlings were killed. The urban © 2011 CISO - Centro Italiano Studi Ornitologici 51 Mazumdar and Kumar nests were attacked by cats (8 nests), mongooses (2 nests), kites (2 nests), snakes (3 nests). As many as 18 rural nests were attacked: two attacks not harmful to the brood, 7 attacks on eggs, 9 attacks on nestlings in which 38 nestlings were killed. The rural nests were attacked by cats (10 nests), mongooses (3 nests), kites (2 nests), snakes (3 nests). Mortality rate among urban nests was 28.75%. In all 46 hatchlings died: 36 killed by predators, bad weather (4), accidentally falling off nests (2), diseases (4). Mortality rate among rural nests was 14.7%. In all 50 hatchlings died: 38 killed by predators, bad weather (4), accidentally falling off nests (3), diseases (5). A two-tailed t-test revealed the difference in mortality cluded that nest predation rates are lower in urban areas than non-urban areas. Fontaine and Martin (2006) demonstrated that birds can assess nest predation risk at large and that nest predation plays a key role in the expression of avian reproduction strategies. Mazumdar and Kumar (2006) studied the nesting ecology of Redwhiskered Bulbul Pycnonotus jocosus in urban and peripheral areas of Lucknow, India. The city centre nests were less in number, showed clumping, had lesser mean depth, clutch size, height, had greater mortality rate, lower nesting success and took a longer duration to complete in comparison to nests on city periphery, which was attributed to better nesting conditions and food availability on city outskirts. DISCUSSION REFERENCES ment among urban and rural house sparrows to better nestcant difference in mortality rate among house sparrows. We concluded that loss of natural nesting sites due to anthropogenic factors in urban areas was responsible for the Ali S 1992. The book of Indian birds. 17th Ed. Oxford University Press, Bombay. Burhans DE 1997. Habitat and microhabitat features associated with cowbird parasitism in two forest edge cowbird hosts. Condor 99: 866-872 Fontaine JJ, Martin TE 2006. Parent birds assess nest predation risk and adjust their reproductive strategies. Ecology Letters 9: 428-434. Hochachka WM, Fink D, Bonter DN, Caruana RA, Kelling ST, Munson A, Riedewald M, Sorokina D 2006. Exploring the ecological consistency of bird conservation regions across a gradient of human density. Proceedings of IV North American Ornithological Conference, p. 367. MacGregor-Fors I, Morales-Perez L, Schondube JE 2006. Shifts in avian communities associated to urbanization in a mountain sub-tropical area. Proceedings of IV North American Ornithological Conference, p. 358. Mazumdar A, Kumar P 2007. Nesting ecology of redwhiskered bulbul, Pycnonotus jocosus (Linnaus). Ukrainian Journal of Ornithology Berkut 1: 98-102. Salvati L, Manganaro A, Fattorini S, Piattella E 1999. Population features of kestrels Falco tinnunculus in urban, suburban and rural areas in central Italy. Acta Ornithologica 34: 53-58. Stracey CM, Robinson SK 2006. Do urban areas act as a refuge from nest predation for an urban “winter”, the North Mockingbird (Mimus polyglottos)? Proceedings of IV North American Ornithological Conference, p. 355. rate in urban and rural areas. Hochachka et al. (2006) found birds varied across rural to urban gradient for several species. Mac Gregor-Fors et al. (2006) studied the effect of urbanization on avian communities in tropical areas. They concluded that species richness is inversely related to urbanization degree while total bird density increases with it. Stracey and Robinson (2006) studied the nests of northern mocking bird Mimus polyglottos, northern cardinals Cardinalis cardinalis and brown thrashers Toxostoma rufum to assess if there were consistent patterns in nest predation rates for different species. They monitored nests in parking lots, residential areas and natural areas and con- Associate Editor: A. Sorace 52 Avocetta 35: 53-60 (2011) Le comunità ornitiche degli ambienti aperti della Sila Grande (Calabria) con note sull’apparente Saxicola rubetra, Regulus regulus e Carduelis spinus ALBERTO SORACE SROPU - Via Roberto Crippa 60 D/8, 00125 Roma ([email protected]) Abstract – Breeding bird communities of open habitats in the Sila Grande Massif (Calabria, Southern Italy) with notes on the possible decrease of Saxicola rubetra, Regulus regulus and Carduelis spinus populations. - of conservation concern, Lullula arborea viscivorus Regulus regulus e Carduelis spinus Saxicola torquata and Turdus Saxicola rubetra - Riassunto specie ecotonali. Tra le 16 specie presenti di interesse conservazionistico, Lullula arborea Saxicola torquata e Turdus viscivorus e durante alcune escursioni nelle aree boschive circostanti, Regulus regulus e Carduelis spinus non sono stati rilevati. Maschi in canto di Saxicola rubetra dionali, anche alcune specie che rivestono un particolare INTRODUZIONE et al et al. 1996) e sull’ornitofauna della Sila (Moltoni 1964). Risul© 2011 CISO - Centro Italiano Studi Ornitologici nero Dryocopus martius, lo Stiaccino Saxicola rubetra, il Regolo Regulus regulus e il Lucherino Carduelis spinus, areale europeo con popolazioni isolate dai principali centri di diffusione continentali (Moltoni 1964). Alcuni dati pubblicati di recente per l’area della Sila Circaetus gallicus, Dryocopus martius, Dendrocopos medius). Tuttavia lo Stiaccino, il Regolo e il Lucherino ri53 Sorace line transect anche Mingozzi 1984). ni sullo status di Stiaccino, Regolo e Lucherino nell’area. sono stati elaborati per ottenere l’abbondanza, espressa co- dionale, si aggiunge un interesse generale per la caratte- durante i transetti. et al. 1996, Sorace et al. 1999, Lorenzetti et al. 2004, Vuerich et al. 2006, Londi et al. 2009, Velatta et al. 2010). - METODI - Line Transect Method et al. ne, sono stati effettuati 14 transetti distribuiti in otto aree - - boschive. Le caratteristiche di ciascun transetto sono riportate in Tab. 1. parte del territorio della Sila Grande. Sono stati considerati solo i dati di individui rileva- - RISULTATI E DISCUSSIONE estensione dell’area investigata nella Sila Grande, rispetto dal 14 al 18 giugno 2008, in giornate senza pioggia e con vento assente o leggero. - alla base di questo risultato. Tuttavia, anche nel caso del totale dei transetti effettuati nelle aree reatine, la cui lun- 54 di un’elevata ricchezza di specie portando a contattare an- 150,2 113,2 675,7 DS 145,6 206,4 1404,7 890,6 200 100 140 100 200 200 110 80 11,5 11,4 18 6 1 2 0 12 Longitudine Distanza min. Cespugli da boschi media 1294 Latitudine 190 1429,7 1424 1449 1682 Latitudine Longitudine punto iniziale punto iniziale 449 601 2068 429 481 Lunghezza Quota iniziale Lago di Cecita 1 Lago di Cecita 2 M. Altare 1 M. Altare 2 Serra Carlo Magno 1 Serra Carlo Magno 2 Silvana Mansio Macchialonga 1 Macchialonga 2 Transetto Tabella 1 9,9 6,8 0 0 0 1 0 0 2 2 0 20 Terreno nudo 17,2 32,8 10 20 40 20 69 Erba 10,3 31,6 20 40 20 20 29 Erba 19,1 29,2 40 20 19 10 0 10 Erba Le comunità ornitiche degli ambienti aperti della Sila Grande 55 Sorace Tabella 2 - Mean values (± SD) of abundance (ind/km) and relative frequency (pi) of the recorded species; IC = species of conservation concern; X = included in All. I of Dir. 79/409/CEE; 2 = SPEC 2, 3 = SPEC 3 (BirdLife International 2004); LR = Low Risk in Italian Red List (LIPU e WWF 1999). Specie media ds pi IC 0.160 Lullula arborea Saxicola torquatus 2.2920 Turdus viscivorus 2.2100 Corvus cornix 2.0192 0.090 2.0119 0.082 - Carduelis cannabina 2 Emberiza cirlus - Emberiza calandra 2 1.4484 - 1.1809 Serinus serinus Lanius collurio 1.2461 Carduelis chloris 1.0226 0.042 - 0.029 Oenanthe oenanthe Emberiza cia 0.6219 Coturnix coturnix 0.6061 - 1.2204 Sylvia communis 0.021 Sturnus vulgaris Motacilla alba 0.6689 Turdus merula 0.6694 Fringilla coelebs 0.2910 Petronia petronia 0.2010 0.6264 0.018 - 0.012 - 0.008 - Pica pica Alauda arvensis 0.006 Phoenicurus phoenicurus 0.006 2 0.006 - Carduelis carduelis 0.1420 - Cyanistes caeruleus Falco tinnunculus 0.004 Periparus ater 0.004 - Anthus trivialis 0.004 - Garrulus glandarius Hirundo rustica 0.0616 0.1814 Upupa epops 0.0616 0.1814 0.1994 Columba palumbus 0.0418 0.0889 Buteo buteo Cuculus canorus - 0.002 Passer montanus Passer italiae 0.002 0.002 Anthus campestris 0.0141 0.002 - 0.001 - 0.001 - dono parte delle aree investigate (i.e. accesso interdetto teresse (Tab. 2). Lo scarso disturbo antropico di cui go56 Le comunità ornitiche degli ambienti aperti della Sila Grande Tabella 3 Breeding community parameters in open habitats of Sila Grande area. S = Richness, A = Abundance, H = Diversity, J = Equitability, % nP = % of non passerines, no. dom. = number of dominant species. Area S A R.N Torriccchio (Appennino 12 - Altopiano di Rascino (RI) 10 Monti della Laga (RI) 8 Sella di Leonessa (RI) 8 J - - - Monte Greco (AQ) 24,6 1,9 0,90 2,0 19,4 - 22 - 2,9 10 - 2,0 18 - 2,9 - 2,9 0,82 Sila Grande a 2,0 a - 10,0 - 0 - 0 - - Sorace 1996 - Lorenzetti et al. 2004 a 0 - Vuerich et al. 2006 a 11,1 - Mancinelli et al. 2009 a 9 Rilievi effettuati con stazioni di ascolto et al. (1989), i dati raccolti lungo un chi- - - piccola Lanius collurio - il Calandro Anthus campestris - - bolini 2009, Londi et al - landra Carduelis canabina e lo Strillozzo Emberiza ca- - Saxicola torquatus e la Tordela Turdus viscivorus sono risultaet al. 1988, Gelli- et al. - Riguardo alle specie di interesse conservazionistico, Circaetus gallicus, Calandrella Calandrella brachydactyla e Averla capirossa Lanius senator et al., - 57 Sorace La Calandrella Calandrella brachydactyla (specie inritoriale, sono stati avvistati il 2 Maggio in un’area vicina lata in passato per l’area (Moltoni 1964, Mingozzi 1984, - Lanius senator et al. 1992, Meschini e - contattato nessun individuo di Regolo e Lucherino, specie proprie delle foreste boreali ad areale relitto in Calabria, senza nelle zone appenniniche potrebbe regredire per efet al et al. - calabra (Scebba et al. - et al individui di questa specie, di cui alcuni in canto, sono staMagno, Silvana Mansio) delle otto aree studiate. La preRingraziamenti – - - - et al Anche i dati del Pan-European Common Bird Monitoring Scheme - della Regione Calabria, ed effettuato da Agriconsulting S.p.A. BIBLIOGRAFIA e della fauna nelle zone protette della Sila Grande. Rapporto et al 58 - - - - - - Le comunità ornitiche degli ambienti aperti della Sila Grande (Lullula arborea) nesting in pine plantations. Journal of Ap- - - - - 2009. Monitoraggio dell’avifauna in una area steppica della th - - 112. Emberiza calandra - lazione inedita. - stico-ecologica ed indicazioni conservazionistico-gestionali. - gionale Scienze Naturali, Torino. La- - - - nius collurio . pp. 59 Sorace Alauda arvensis e tottavilla Lullula arborea nell’Appenni- - - - Associate Editor: T. Mingozzi 60 Avocetta 35: 61-64 (2010) Columns - Rubriche - - Popolazioni di uccelli acquatici in italia - update A CURA DI MARCO GUSTIN1 E ALBERTO SORACE2 Questa rubrica, come già accaduto in passato, ha lo scopo riproduttivo) delle specie “rare” o comunque localizzate di Si invitano tutti gli ornitologi italiani a collaborare, consapevoli dell’importanza di aggiornare annualmente colonizzazione nel nostro Paese, comunicando ai curatori della rubrica i dati in vostro possesso, in particolare sulle seguenti specie: Marangone minore ( ), Airone bianco maggiore ( ), Tarabuso (Botaurus stellaris), Cicogna nera ( ), Mignattaio ( ), Spatola (Platalea leucorodia), Fenicottero ( ), Volpoca (Tadorna tadorna), Anatra marmorizzata ( ), Moretta ( ), Moretta tabaccata ( ca), Edredone ( ), Smergo maggiore ( ), Pernice di mare (Glareola pratincola), Beccaccia di mare ( ), Chiurlo maggiore (Numenius arquata), Pittima reale (Limosa limosa), Gabbiano corallino ( ), Gabbia- no roseo ( ), Sterna zampenere (Gelo), Sterna di Rueppel ( ), Beccapesci ( ), Mignattino piombato ( ), Mignattino alibianche ( leucoptera), Mignattino comune ( ), Forapaglie comune ( ) e Basettino (Panurus Chiunque sarà disponibile a fornire dati su queste specie potrà inviare le proprie segnalazioni sotto forma di breperiodo riproduttivo (settembre-ottobre) dell’anno al quanell’anno 2002 (Avocetta, 29: 41-55), in questa fase di rilancio della rubrica saranno prese in considerazione anche osservatori e la citazione consigliata di una segnalazione dovrebbe essere effettuata secondo questo modello: Marangone minore , Piallasse e Valli 1 43100 Parma; 2 61 Columns - Rubriche Book Reviews - Recensioni - - mi sono sottratti ogni anno alla vita selvatica; nel 2004 ne sono stati catturati oltre centomila, in particolare verdoni , fringuelli , fanelli Care verzellini - Gauci e Victor Falzon, leader nella conservazione della na- cambiare; dal 2009 la cattura di fringillidi è illegale, sebbene sia consentita l’uccellagione a tortore, quaglie e pivieri dorati (Pluvialis apricaria); ancora i controlli non sono molto rigidi e il divieto di cattura di fringillidi è un obiettivo che potrà essere raggiunto solo in tempi lunghi; le sta- SULTANA J, BORG JJ, GAUCI C, FALZON V - maltese è antica ed ha avuto sempre rappresentanti di ottidue guide illustrate sugli uccelli maltesi ed un atlante degli tologi molto impegnati sia nello studio degli uccelli, sia nell’inanellamento, sia nella conservazione e tutela degli habitat, che nel corso degli ultimi anni ha visto una part- 2 - per km2 cacciatori, 50 per km2 nel capitolo introduttivo vi è una sintetica descrizione delle isole e la storia dell’ornitologia locale; vi è anche una sintesi delle lotte che gli ornitologi hanno dovuto affrontare per vedere rispettati i diritti internazionali degli uccelli bile tra le 10 e le 20 pagine, che sintetizzano fedelmente lo stato di ciascuna, riportando fedelmente tutti i dati storici e la posizione sistematica, la distribuzione, i caratteri distintivi, il canto, la dieta, lo status, l’habitat, la distribuzione, il comportamento riproduttivo, gli studi in corso, l’anda- zione che in passato hanno avuto delle leggi venatorie e del fatto che la caccia è diretta in larga misura a specie migratrici, che quindi coinvolgono gli interessi di diversi altri Paesi europei ed almeno un paio di continenti, Africa ed diversi legati alle attività di conservazione che nel tempo sono state rivolte a ciascuna specie, come la creazione di isole di ghiaia per i corrieri piccoli ( )o i francobolli con il passero solitario (Monticola solitarius), Malta è anche caratterizzata da un’antica tradizione di uccellagione, dalla cattura di uccelli in siti appositamente )e quaglie ( ) sono state catturate e consumate nelle tavole dei maltesi, mentre i fringillidi sono sta- Particolarmente curati e ricchi di informazioni sono gli uccelli marini, berta maggiore (Calonectris d. diomedea), berta minore mediterranea ( ) e uccello delle tempeste mediterraneo ( melitensis 63 Columns - Rubriche tenuti con i GPS, ma anche gli spostamenti tra le isole di Cettia cetti), l’alimentazione del beccamoschino (Cisticola juncidis), la longevità dell’occhiocotto ( ) in tempi storici della taccola (Corvus monedula) è abbastanza sintomatica del rapporto uomo-natura che ha caratterizverte attraverso la lettura di questo bel volume e la visione Seguono capitoli di minore lunghezza dedicati a un nu- L’opera è certamente il risultato delle nozioni acquisite durante l’intera vita degli autori in materia ornitologica, ma anche delle capacità di interazione di un gruppo molto logica inglese, tuttavia perfettamente integrato nella realtà avanti con molto impegno da parte dei maltesi che si ocmolto probabilmente è la causa del fatto che alcune specie Falco tinnunculus), il pellegrino ( ), il barbagianni ( 64 a meno di consultare questo volume, che quindi non potrà Bruno Massa


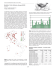

 species, resident from October to March, we recorded a continuous
increase in body weight, even when the environrnental temperature
was rising in Febraury and March. This pattern of weight variatio...
species, resident from October to March, we recorded a continuous
increase in body weight, even when the environrnental temperature
was rising in Febraury and March. This pattern of weight variatio...